ഓക്സൈഡ്
രാസസൂത്രത്തിൽ, ഓക്സിജന്റെ കുറഞ്ഞത് ഒരു ആറ്റവും മറ്റേതെങ്കിലും ഒരു മൂലകമെങ്കിലുമുള്ള രാസസംയുക്തത്തെയാണ് ഓക്സൈഡ് അല്ലെങ്കിൽ ഓക്സൈഡുകൾ (Oxide) /ˈɒksaɪd//ˈɒksaɪd/ എന്നു വിളിക്കുന്നത്.[1] ഓക്സൈഡ് എന്നു പറഞ്ഞാൽത്തന്നെ ഓക്സിജന്റെ ഡൈആനയോൺ ആണ്, അതായത് ഒരു O2– ആറ്റം. സാധാരണയ്ക്ക് ലോഹ ഓക്സിഡുകളിൽ ഓക്സിഡേഷൻ നില −2 ഉള്ള ഓക്സിജന്റെ ഒരു ആനയോൺ ആവും ഉണ്ടാവുക. ഭൂവൽക്കത്തിലെ ഖരരൂപം മിക്കതും ജലത്തിന്റെയോ വായുവിന്റെയോ സാന്നിധ്യത്തിൽ ഓക്സിജൻ മറ്റുമൂലകങ്ങളുമായി പ്രവർത്തിച്ച് ഉണ്ടാകുന്ന ഖരഓക്സൈഡുകളാണ്. ഹൈഡ്രോകാർബൺ കത്തുമ്പോഴാണ് രണ്ടു പ്രമുഖ കാർബൺ ഓക്സൈഡുകളായ കാർബൺ മോണോക്സൈഡും കാർബൺ ഡയോക്സൈഡും ഉണ്ടാവുന്നത്. ശുദ്ധരൂപത്തിൽ സ്ഥിതിചെയ്യുന്ന മൂലകങ്ങൾ പോലും അവയുടെ പുറത്ത് ഒരു ഓക്സൈഡ് പാടയിൽ പൊതിഞ്ഞാവും ഉണ്ടാവുക. ഉദാഹരണത്തിന് അലൂമിനിയത്തെപ്പൊതിഞ്ഞ് അലൂമിനിയം ഓക്സൈഡിന്റെ (Al2O3) ഒരു നേരിയ പാട ഉണ്ടാവും, ഇതാണ് കൂടുതൽ നാശനത്തിൽ നിന്നും അലൂമിനിയത്തെ തടയുന്നത്.[2] പലമൂലകങ്ങളും ഒന്നിലധികം ഓക്സൈഡ് രീതിയിൽ കാണാറുണ്ട്. ഓരോന്നിലും ഓക്സിജന്റെയും ആ മൂലകങ്ങളുടെയും എണ്ണം വ്യത്യാസപ്പെട്ടിരിക്കും.. In some cases these are distinguished by specifying the number of atoms as in carbon monoxide and carbon dioxide, and in other cases by specifying the element's oxidation number, as in iron(II) oxide and iron(III) oxide. Certain elements can form many different oxides, such as those of nitrogen.
രൂപപ്പെടൽ[തിരുത്തുക]

ഘടന[തിരുത്തുക]
ലോഹങ്ങളുടെ ഓക്സൈഡുകൾ[തിരുത്തുക]
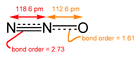
തന്മാത്രാ ഓക്സൈഡുകൾ[തിരുത്തുക]
- Some important gaseous oxides
-
Carbon dioxide is the main product of fossil fuel combustion.
-
Carbon monoxide is the product of the incomplete combustion of carbon-based fuels and precursor to many useful chemicals.
-
Nitrogen dioxide is a problematic pollutant from internal combustion engines.
-
Sulfur dioxide, the principal oxide of sulfur, is emitted from volcanoes.
-
Nitrous oxide ("laughing gas") is a potent greenhouse gas produced by soil bacteria.
റിഡക്ഷൻ[തിരുത്തുക]
കാർബൺ ഉപയോഗിച്ചുള്ള റിഡക്ഷൻ[തിരുത്തുക]
ചൂടാക്കിയുള്ള റിഡക്ഷൻ[തിരുത്തുക]
സ്ഥാനമാറ്റത്തിൽക്കൂടിയുള്ള റിഡക്ഷൻ[തിരുത്തുക]
ഹൈഡ്രജൻ ഉപയോഗിച്ചുകൊണ്ടുള്ള റിഡക്ഷൻ[തിരുത്തുക]
വൈദ്യുതി ഉപയോഗിച്ചുള്ള റിഡക്ഷൻ[തിരുത്തുക]
Hydrolysis and dissolution[തിരുത്തുക]
Reductive dissolution[തിരുത്തുക]
നാമകരണങ്ങളും രാസസൂത്രങ്ങളും[തിരുത്തുക]
ഓക്സിഡുകളുടെ ഉദാഹരണങ്ങൾ[തിരുത്തുക]
The following table gives examples of commonly encountered oxides. Only a few representatives are given, as the number of polyatomic ions encountered in practice is very large.
| Name | Formula | Found/Usage |
|---|---|---|
| Water (hydrogen oxide) | H 2O |
Common solvent, Required by carbon-based life |
| Nitrous oxide | N 2O |
Laughing gas, anesthetic (used in a combination with diatomic oxygen (O2) to make Nitrous oxide and oxygen anesthesia), produced by Nitrogen-fixing bacteria, Nitrous, oxidizing agent in rocketry, aerosol propellant, recreational drug, greenhouse gas. Other nitrogen oxides such as NO 2NO |
| Silicon dioxide | SiO 2SiO |
Sand, quartz |
| Iron(II,III) oxide | Fe 3O |
Iron Ore, Rust, along with iron(III) oxide (Fe 2O |
| Aluminium oxide | Al 2O |
Aluminium Ore, Alumina, Corundum, Ruby (Corundum with impurities of Chromium). |
| Zinc oxide | ZnO | Required for vulcanization of rubber, additive to concrete, sunscreen, skin care lotions, antibacterial and antifungal properties, food additive, white pigment. |
| Carbon dioxide | CO 2CO |
Constituent of the atmosphere of Earth, the most abundant and important greenhouse gas, used by plants in photosynthesis to make sugars, product of biological processes such as respiration and chemical reactions such as combustion and chemical decomposition of carbonates. CO or Carbon monoxide exists as a product of incomplete combustion and is a highly toxic gas. |
| Calcium oxide | CaO | Quicklime (used in construction to make mortar and concrete), used in self-heating cans due to exothermic reaction with water to produce Calcium hydroxide, possible ingredient in Greek fire and produces limelight when heated over 2,400 °Celsius. |
ഇവയും കാണുക[തിരുത്തുക]
- Other oxygen ions ozonide, O3−, superoxide, O2−, peroxide, O22− and dioxygenyl, O2+.
- Suboxide
- Oxohalide
- Oxyanion
- Complex oxide
- See Category:Oxides for a list of oxides.
- Salt
അവലംബം[തിരുത്തുക]
- ↑ Foundations of College Chemistry, 12th Edition
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.