കാർബൺ ഡയോക്സൈഡ്
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Carbon dioxide
| |||
| Other names
Carbonic acid gas; carbonic anhydride; dry ice (solid)
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.004.271 | ||
| EC Number |
| ||
PubChem CID
|
|||
| RTECS number |
| ||
| UN number | 1013 Solid (dry ice): 1845 Mixtures with Ethylene oxide: 1952,3300 | ||
CompTox Dashboard (EPA)
|
|||
| InChI | |||
| SMILES | |||
| Properties | |||
| തന്മാത്രാ വാക്യം | |||
| Molar mass | 0 g mol−1 | ||
| Appearance | colorless, odorless gas | ||
| സാന്ദ്രത | 1.562 g/mL (solid at 1 atm and −78.5 °C) 0.770 g/mL (liquid at 56 atm and 20 °C) 1.977 g/L (gas at 1 atm and 0 °C) 849.6 g/L (supercritical fluid at 150 atm and 30 °C | ||
| ദ്രവണാങ്കം | |||
| ക്വഥനാങ്കം | |||
| 1.45 g/L at 25 °C, 100 kPa | |||
| അമ്ലത്വം (pKa) | 6.35, 10.33 | ||
| Refractive index (nD) | 1.1120 | ||
| വിസ്കോസിറ്റി | 0.07 cP at −78 °C | ||
| zero | |||
| Structure | |||
| linear | |||
| Related compounds | |||
| Other anions | Carbon disulfide | ||
| Other cations | Silicon dioxide Germanium dioxide Tin dioxide Lead dioxide | ||
| Related carbon oxides | Carbon monoxide Carbon suboxide Dicarbon monoxide Carbon trioxide | ||
| Related compounds | Carbonic acid Carbonyl sulfide | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
ഭൂമിയുടെ അന്തരീക്ഷത്തിൽ സ്വതന്ത്രമായും ജലാശയങ്ങളിൽ ഭാഗികമായി ലയിച്ച അവസ്ഥയിലും പ്രകൃത്യാ കാണപ്പെടുന്ന ഒരു രാസസംയുക്തമാണു് കാർബൺ ഡയോക്സൈഡ് അഥവാ ഇംഗാലാമ്ലവാതകം. CO2 എന്നാണു് ഇതിന്റെ രാസസൂത്രം. രണ്ട് ഓക്സിജൻ അണുക്കൾ ഒരു കാർബൺ അണുവുമായി സഹസംയോജകബന്ധനത്തിൽ പരസ്പരം ഘടിപ്പിക്കപ്പെട്ട സംയുക്തമാണ് കാർബൺ ഡയോക്സൈഡ്. അന്തരീക്ഷത്തിലെ സാധാരണ താപനിലയിലും മർദ്ദത്തിലും കാർബൺ ഡയോക്സൈഡ് വാതകാവസ്ഥയിൽ കാണപ്പെടുന്നു. ഖര രൂപത്തിലുള്ള കാർബൺ ഡൈഓക്സൈഡിന് ഡ്രൈ ഐസ് എന്നാണു പറയുന്നത്. സസ്യങ്ങൾ പ്രകാശസംശ്ലേഷണത്തിലൂടെ സ്വീകരിക്കുന്ന വാതകമാണിത്. 2009 മാർച്ചിലെ, കണക്കുകൾ പ്രകാരം ഭൂമിയുടെ അന്തരീക്ഷത്തിൽ വ്യാപ്തത്തിലെ ഒരു ദശലക്ഷത്തിൽ 387 ഭാഗം (387 ppm) കാർബൺ ഡയോക്സൈഡ് ആണ്. പതിനെട്ടാം നൂറ്റാണ്ടിന്റെ ഉത്തരാർദ്ധത്തിൽ ആവിയന്ത്രങ്ങൾ പ്രചാരമായ കാലം മുതൽ അന്തരീക്ഷത്തിലെ കാർബൺ ഡയോക്സൈഡിന്റെ അളവു് അത്യഭൂതപൂർവ്വമായ അളവിൽ വർദ്ധിച്ചുകൊണ്ടിരിക്കുന്നു. നൈട്രജൻ, ഓക്സിജൻ, നീരാവി തുടങ്ങിയവയുമായി താരതമ്യം ചെയ്യുമ്പോൾ വളരെ കുറവാണെന്നു തോന്നാമെങ്കിലും, ഭൂമിയുടെ അന്തരീക്ഷതാപനില ഉയർത്തുന്നതിൽ പങ്കുവഹിക്കുന്ന ഹരിതഗൃഹവാതകങ്ങളിൽ ഒരു ഗണ്യമായ പങ്കു് ജൈവപ്രക്രിയകളിൽ അധികബാദ്ധ്യതയായി വരുന്ന കാർബൺ ഡൈ ഓക്സൈഡിന്റേതാണു്. [1]
മറ്റു ഗ്രഹങ്ങളിൽനിന്നു വ്യത്യസ്തമായി ഭൂമിയിൽ ജീവൻ നിലനിൽക്കുന്നതിൽ ഒരു പ്രധാന പങ്കു് കാർബൺ ഡയോക്സൈഡിനുണ്ടു്. കാർബൺ ചക്രത്തിലെ കാർബണിന്റെ പുനർവിതരണം നടക്കുന്നതു് ഈ വാതകത്തിലൂടെയാണു്. സൂക്ഷ്മതരങ്ങളായ പായൽ അടക്കമുള്ള സസ്യങ്ങളും സയനോബാക്റ്റീരിയകളും അന്തരീക്ഷത്തിൽ ലഭ്യമായ കാർബൺ ഡയോക്സൈഡിനെ ജലത്തിന്റേയും സൂര്യപ്രകാശത്തിന്റേയും സഹായത്താൽ കാർബോഹൈഡ്രേറ്റുകളും ഹൈഡ്രോകാർബണുകളും മറ്റു കാർബണികസംയുക്തങ്ങളുമാക്കി മാറ്റുന്നു. ഇതിനെയാണു് പ്രകാശസംശ്ലേഷണം എന്നു പറയുന്നതു്.
ഈ ഉല്പന്നങ്ങൾ പ്രയോജനപ്പെടുത്തിയാണു് കുമിളുകൾ അടക്കമുള്ള മറ്റു ജീവികളും ജന്തുക്കളും തങ്ങളുടെ ജൈവപ്രക്രിയകൾ സാദ്ധ്യമാക്കുന്നതു്. ഇത്തരം ജൈവപ്രക്രിയകളെ അപചയനം അഥവാ ജാരണം (മെറ്റാബോളിസം) എന്നു വിളിക്കുന്നു. മുഖ്യമായും അപചയനത്തിൽ നടക്കുന്നതു് പ്രകാശസംശ്ലേഷണത്തിന്റെ വിപരീതപ്രവർത്തനമാണു്. അതായതു് ജന്തുക്കൾ അകത്താക്കുന്ന ആഹാരത്തിനു് വായുവിലെ ഓക്സിജന്റെ സഹായത്തോടെ രാസവിഘടനം നടന്നു് അതിലെ കാർബൺ സംയുക്തങ്ങൾ തിരിച്ച് കാർബൺ ഡയോക്സൈഡും ജലവുമായി മാറുന്നു. അതിനോടൊപ്പം ജന്തുക്കൾക്കാവശ്യമായ കായികോർജ്ജവും ചൂടും ലഭിയ്ക്കുകയും ചെയ്യുന്നു.
കൂടാതെ, പ്രകാശസംശ്ലേഷണത്തിലൂടെ ഉല്പാദിപ്പിക്കപ്പെട്ട കാർബണികസംയുക്തങ്ങൾ ഉടനെത്തന്നെയോ കാലക്രമേണയോ ഊർജ്ജപ്രദായകങ്ങളായ ഇന്ധനങ്ങളായി മാറുന്നു. വിറകു്, ചാണകം, കൽക്കരി, പെട്രോളിയം, പ്രകൃതിവാതകം ഇവയെല്ലാം ഇത്തരം ഇന്ധനങ്ങളാണു്. ഇവയെയാണു് ഫോസിൽ ഇന്ധനങ്ങൾ എന്നു വിളിക്കുന്നതു്. ഫലത്തിൽ ഇവയും പ്രകാശസംശ്ലേഷണത്തിന്റെ വിപരീതപ്രവർത്തനമാണു്. ഫോസിൽ ഇന്ധനങ്ങൾ വായുവിലെ ഓക്സിജന്റെ സഹായത്തോടെ കത്തുമ്പോൾ ഓക്സീകരണം നടന്നു് ചൂടോ വാതകമർദ്ദമോ ആയി ഊർജ്ജവും കാർബൺഡയോക്സൈഡും നീരാവിയും ഉണ്ടാകുന്നു.
ഏകദേശം ഭൂമിയിൽ ജീവൻ പ്രത്യക്ഷപ്പെട്ട കാലം മുതൽ തുടർന്നുവരുന്ന ഈ പ്രതിപ്രവർത്തനചക്രങ്ങളാണു് ഇപ്പോൾ നാം കാണുന്ന എല്ലാ ജീവജാലങ്ങളുടേയും നിലനിൽപ്പിനു് ആധാരം.
ഘടനയും രാസസംയോജനശീലവും
[തിരുത്തുക]കാർബൺ ഡയോക്സൈഡിന്റേതു് രേഖീയവും കേന്ദ്രീയസദൃശവും ആയ തന്മാത്രകളാണു്. ഹ്രസ്വവും തുല്യവുമായ രണ്ടു് C-O രാസബന്ധനങ്ങൾ എപ്പോഴും ഇരട്ടബന്ധനങ്ങളായി കാണപ്പെടുന്നു. കേന്ദ്രീയസദൃശത മൂലം ഇവയിൽ ജലതന്മാത്രകളും മറ്റും പോലെ വൈദ്യുത ഡൈപോളുകൾ ഇല്ല. ഈ വസ്തുതയോടു ചേർന്നു പോകുന്നവിധത്തിൽ തന്നെ, കാർബൺ ഡയോക്സൈഡിന്റെ ഇൻഫ്രാറെഡ് വികിരണമണ്ഡലത്തിൽ അപസദൃശ വികാസാവസ്ഥയിൽ (anti-symmetric stretching mode) 2349 cm-1, വക്രിതാവസ്ഥയിൽ (bending mode) 666cm-1 എന്നിങ്ങനെ രണ്ടേ രണ്ടു് കമ്പിതാവൃത്തികൾ (vibrational bands) കാണപ്പെടുന്നു. എന്നാൽ രാമൻ വികിരണമണ്ഡലത്തിൽ നിരീക്ഷിക്കാവുന്ന 1388 ആവൃത്തിയുള്ള ഒരു സദൃശവികാസാവസ്ഥ (symmetric stretching mode) കൂടി കാർബൺ ഡയോക്സൈഡിനുണ്ടു്. fgfdfhad
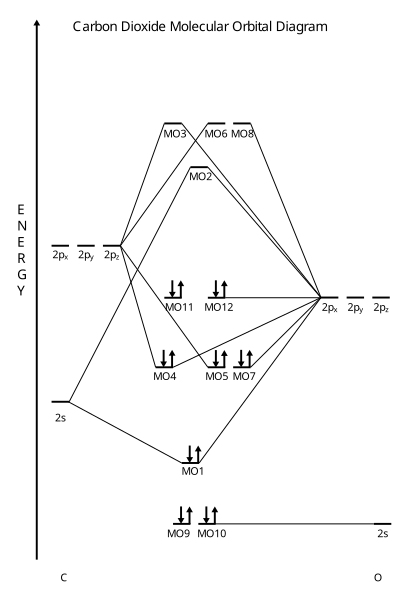
- കാർബൺ ഡയോക്സൈഡിന്റെ തന്മാത്രാഭ്രമണപഥ മാതൃക (MO മോഡൽ)
-
അണുപഥങ്ങൾ
-
തന്മാത്രാപഥങ്ങൾ
-
MO മോഡൽ സൂചനാചിത്രം
ജലത്തിൽ ലയിക്കുമ്പോൾ
[തിരുത്തുക]സാമാന്യം നന്നായി ജലത്തിൽ ലയിക്കുന്ന ഒരു വാതകമാണു് കാർബൺ ഡയോക്സൈഡ്. ലയിച്ച അവസ്ഥയിൽ അതിന്റെ ഒരു ചെറിയ ഭാഗം കാർബോണിൿ അമ്ലം (H
2CO
3)ആയി മാറുന്നു. ഇതൊരുഉഭയദിശാപ്രവർത്തനം ആണു്. വാതകങ്ങളുടെ ഭാഗികമർദ്ദത്തെ സംബന്ധിച്ച ഹെന്രി നിയമം പരിഗണിച്ചാൽ 25°C താപനിലയിൽ ആണു് കാർബോണിൿ അമ്ലത്തിന്റെ ജലലയനസ്ഥിരാങ്കം (hydration equilibrium constant). ഇതിനർത്ഥം, വാതകാവസ്ഥയിൽ ലയിച്ചുചേർന്നതിനേക്കാൾ വളരെ ചെറിയ ഒരു ഭാഗം കാർബൺ ഡയോക്സൈഡ് മാത്രമേ കാർബോണിൿ ആസിഡായി മാറുന്നുള്ളൂ എന്നാണു്. ലയിച്ചുചേർന്ന, എന്നാൽ കാർബോണിൿ അമ്ലമായി മാറാതെ അവശേഷിക്കുന്ന കാർബൺ ഡയോക്സൈഡ് ലായനിയുടെ അമ്ലാവസ്ഥയെ (pH) ബാധിക്കുന്നില്ല.
എന്നാൽ, ലായനിയുടെ ആകമാനമുള്ള pH അനുസരിച്ച് അതിലടങ്ങിയ കാർബോണിൿ അമ്ലം, CO2 വാതകം, കാർബണേറ്റ്, ബൈ കാർബണേറ്റ് ലവണാംശങ്ങൾ എന്നിവയുടെ പരസ്പരമുള്ള അനുപാതം വ്യത്യാസപ്പെട്ടിരിക്കും. ക്ഷാരാവസ്ഥ തീരെയില്ലാത്തതോ അത്യന്തം കുറഞ്ഞതോ ആയ ലായനിയിൽ (6.5-നു മുകളിൽ pH) ബൈകാർബണേറ്റ് അംശവും ക്ഷാരാവസ്ഥ വളരെ ഉയർന്ന ലായനിയിൽ (pH>10.4) കാർബണേറ്റ് അംശവും കൂടുതലായി കാണാം. ഏകദേശം 8.2 മുതൽ 8.5 വരെ pH ഉള്ള, നേരിയ ക്ഷാരാവസ്ഥയുള്ള സമുദ്രജലത്തിൽ ഒരു ലിറ്ററിനു് ഏകദേശം 120 മില്ലിഗ്രാം എന്ന കണക്കിൽ ബൈകാർബണേറ്റുകൾ കാണപ്പെടുന്നു.
ഭൗതികഗുണങ്ങൾ
[തിരുത്തുക]

നിറമില്ലാത്ത ഒരു വാതകമാണു് കാർബൺ ഡയോക്സൈഡ്. സാധാരണ ഗാഢതയിൽ മണമില്ല. പക്ഷേ, അത്യന്തം സാന്ദ്രമായ അവസ്ഥയിൽ പുളിപ്പുള്ള ഒരു രൂക്ഷഗന്ധം അനുഭവപ്പെടുന്നു.
സാമാന്യത്തിലധികം ഭാരമുള്ള ഒരു വാതകമാണിതു്. അന്തരീക്ഷവായുവുമായി താരതമ്യം ചെയ്യുമ്പോൾ ജലം പോലെ താഴോട്ടൊഴുകുവാനും ഒരു പാത്രത്തിൽനിന്നും ഏറെക്കുറെ മറ്റൊരു പാത്രത്തിലേക്കു് ഒഴിക്കുവാനും തക്ക ഭാരം കാർബൺ ഡയോക്സൈഡിനുണ്ടു്. മാനകതാപത്തിലും മർദ്ദത്തിലും വായുവിനേക്കാൾ ഏകദേശം ഒന്നര മടങ്ങു് (1.98 കി.ഗ്രാം / ഘനമീറ്റർ) സാന്ദ്രതയുണ്ടു്.
അവലംബം
[തിരുത്തുക]- Articles without EBI source
- Articles without KEGG source
- Articles without UNII source
- Articles with changed CASNo identifier
- Chembox and Drugbox articles with a broken CheMoBot template
- ECHA InfoCard ID from Wikidata
- Pages using Chembox with unknown parameters
- Chembox image size set
- രസതന്ത്രം - അപൂർണ്ണലേഖനങ്ങൾ
- കാർബൺ ഡയോക്സൈഡ്
- ഓക്സൈഡുകൾ
- ഹരിതഗൃഹ വാതകങ്ങൾ
- ശീതീകാരികൾ
- ആണവറിയാക്റ്ററുകളിലെ ശീതീകാരികൾ





![{\displaystyle K_{\mathrm {h} }={\frac {\rm {[H_{2}CO_{3}]}}{\rm {[CO_{2}(aq)]}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)
