ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ
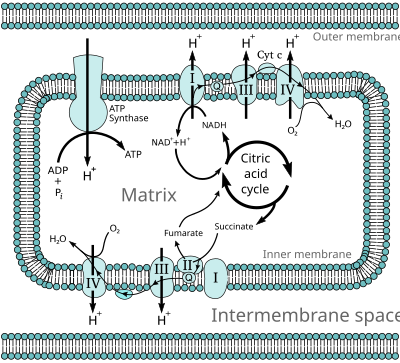
രാസാഗ്നികൾ ഉപയോഗിച്ച് കോശങ്ങൾ പോഷകാഹാരങ്ങൾ ഓക്സീകരിക്കപ്പെടുന്ന മെറ്റബോളിക് പാത്ത് വേ (ഉപാപചയ വഴി) ആണ് ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ (UK /ɒkˈsɪd.ə.tɪv/, US /ˈɑːk.sɪˌdeɪ.tɪv/)[1] അതുവഴി ഊർജ്ജം സ്വതന്ത്രമാക്കപ്പെടുകയും ആ ഊർജ്ജം അഡിനോസിൻ ട്രൈഫോസ്ഫേറ്റ് (ATP)[2] ഉത്പാദിപ്പിക്കാൻ ഉപയോഗിക്കുകയും ചെയ്യുന്നു. യൂക്കാരിയോട്ടുകളിൽ ഈ രാസപ്രവർത്തനം മൈറ്റോകോൺട്രിയയ്ക്കുള്ളിൽ[3] ആണ് നടക്കുന്നത്. മിക്കവാറും എല്ലാ എയറോബിക് ജീവികളിലും[4] ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ നടക്കുന്നു. അനെയ്റോബിക് ഗ്ലൈക്കോളിസിസ് പോലെയുള്ള ഒന്നിടവിട്ടുള്ള ഫെർമെൻറേഷൻ പ്രക്രിയയിൽ ഊർജ്ജം സ്വതന്ത്രമാക്കാനുള്ള ഏറ്റവും ഫലപ്രദമായ വഴിയാണ് ഇത്.
ഓക്സിഡേഷൻ ഫോസ്ഫോറിലേഷൻ പ്രവർത്തനം നടക്കുമ്പോൾ, ഇലക്ട്രോണുകൾ ഇലക്ട്രോൺ ദാതാക്കളിൽ നിന്നും ഓക്സിജൻ പോലുള്ള സ്വീകർത്താക്കൾക്ക് റിഡോക്സ് പ്രവർത്തനത്തിലൂടെ കൈമാറ്റം ചെയ്യുന്നു. ഈ റിഡോക്സ് പ്രവർത്തനം ഊർജ്ജം സ്വതന്ത്രമാക്കുകയും, ഇത് എ.ടി.പി. രൂപീകരിക്കാൻ ഉപയോഗിക്കുന്നു. യൂക്കാരിയോട്ടുകളിൽ, ഈ റിഡോക്സ് പ്രവർത്തനങ്ങൾ കോശത്തിന്റെ മൈറ്റോകോൺട്രിയയുടെ ഉൾഭാഗത്ത് ഉള്ള പ്രോട്ടീൻ സംയുക്തങ്ങളിൽ നടത്തപ്പെടുന്നു. പ്രോകാരിയോട്ടുകളിൽ, ഈ പ്രോട്ടീനുകൾ ചർമ്മപാളികൾക്കിടയിലുള്ള കോശങ്ങളിൽ കാണപ്പെടുന്നു. ഈ പ്രോട്ടീനുകളുടെ കൂട്ടത്തെ ബന്ധിപ്പിക്കുന്ന കണ്ണിയെ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖല[5] എന്നു വിളിക്കുന്നു. യൂക്കാരിയോട്ടുകളിൽ, അഞ്ച് പ്രധാന പ്രോട്ടീൻ സംയുക്തങ്ങൾ ഉൾപ്പെടുന്നു, എന്നാൽ പ്രോകാരിയോട്ടുകളിൽ ധാരാളം വ്യത്യസ്ത എൻസൈമുകളും കാണപ്പെടുന്നു, വിവിധതരത്തിലുള്ള ഇലക്ട്രോൺ ദാതാക്കളായും സ്വീകർത്താക്കളായും ഇവ ഉപയോഗിക്കുന്നു.
ഈ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖല മുഖേന ഇലക്ട്രോണുകൾ സഞ്ചരിക്കുമ്പോൾ പുറത്തുവിടുന്ന ഊർജ്ജം ആന്തരിക മൈറ്റോകോൺട്രിയൽ സ്തരങ്ങളിലൂടെ പ്രോട്ടോണുകളെ കൊണ്ടുവരാൻ ഉപയോഗിക്കുന്നു. ഈ പ്രക്രിയയെ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് എന്നു വിളിക്കുന്നു. ഇത് പി.എച്ച് ഗ്രേഡിയൻറിന്റെ രൂപത്തിൽ സ്ഥിതികോർജ്ജം സൃഷ്ടിക്കുന്നു. ഇത് സ്തരങ്ങളിലുടനീളം വൈദ്യുത സാധ്യതയുണ്ടാക്കുന്നു. പ്രോട്ടോണുകൾ സ്തരങ്ങൾക്കു പുറത്തേക്ക് സഞ്ചരിക്കുമ്പോൾ, ശേഷിച്ച സ്ഥിതികോർജ്ജ ഗ്രേഡിയന്റ് ഒരു വലിയ എൻസൈം വഴി കുറയുന്നു. ഈ എൻസൈമിനെ ATP സിന്തേസ് എന്നുവിളിക്കുന്നു. ഈ പ്രക്രിയയെ കെമിയോസ്മോസിസ് എന്നറിയപ്പെടുന്നു. ഫോസ്ഫോറിലേഷൻ രാസപ്രവർത്തനത്തിൽ ATP സിന്തേസ് അഡിനോസിൻ ഡൈഫോസ്ഫേറ്റ് (ADP)[6] അഡിനോസിൻ ട്രൈഫോസ്ഫേറ്റ് ആയി മാറ്റുന്നതിന് ഈ ഊർജ്ജത്തെ ഉപയോഗിക്കുന്നു. ഈ രാസപ്രവർത്തനം പ്രോട്ടോൺ പ്രവാഹത്താൽ നയിക്കപ്പെടുന്നു. ഇത് എൻസൈമിൻറെ ഒരു ഭാഗത്തിന്റെ ഭ്രമണം നിയന്ത്രിക്കുന്നു. ATP സിന്തേസ് ഒരു റോട്ടറി മെക്കാനിക്കൽ മോട്ടർ ആയി പ്രവർത്തിക്കുന്നു.
ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ ഉപാപചയ പ്രവർത്തനത്തിന്റെ ഒരു സുപ്രധാന ഭാഗമാണെങ്കിലും സൂപ്പർ ഓക്സൈഡ്, ഹൈഡ്രജൻ പെറോക്സൈഡ്, എന്നിവ പോലുള്ള രാസപ്രവർത്തനങ്ങളിൽ ഓക്സിജൻ സ്പീഷീസുകളെ സൃഷ്ടിക്കുന്നു. ഇത് ഫ്രീ റാഡിക്കലുകളുടെ രൂപീകരണത്തിലേയ്ക്ക് രാസപ്രവർത്തനത്തെ നയിക്കുന്നു. ഈ ഫ്രീ റാഡിക്കലുകൾ, കോശങ്ങളുടെ നാശം, വാർദ്ധക്യം (senescence), രോഗങ്ങൾ എന്നിവയിലേയ്ക്ക് നയിക്കുന്നു. ഈ ഉപാപചയ വഴികളെ നയിക്കുന്ന എൻസൈമുകൾ നിരവധി മരുന്നുകളുടെയും വിഷാംശങ്ങളുടെയും പ്രവർത്തനങ്ങളെ തടയുന്നു.
ഇത് യൂക്കാരിയോട്ടുകളിൽ കോശ ശ്വസനത്തിന്റെ അവസാന പ്രക്രിയയാണ്. ഇതിൻറെ ഫലമായി ഉയർന്ന അളവിൽ ATP ലഭിക്കുന്നു.
കെമിയോസ്മോസിസ്
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: കെമിയോസ്മോസിസ് ആൻഡ് ബയോഎനർജെറ്റിക്സ്
ഊർജ്ജം സ്വതന്ത്രമാകുന്ന രാസപ്രവർത്തനങ്ങളിലൂടെ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ പ്രവർത്തിക്കുകയും അത് ഊർജ്ജം ആവശ്യമുള്ള രാസപ്രവർത്തനങ്ങളിലേയ്ക്ക് നയിക്കുകയും ചെയ്യുന്നു. ഊർജ്ജം സ്വതന്ത്രമാകുന്ന രാസപ്രവർത്തനവും ഊർജ്ജം ആവശ്യമായ രാസപ്രവർത്തനവും തമ്മിൽ കൂടിച്ചേരുകയും ചെയ്യുന്നു. രണ്ടു രാസപ്രവർത്തനങ്ങളും ഒന്നിനോടൊന്നു ബന്ധപ്പെട്ടിരിക്കുന്നതായി മനസ്സിലാക്കാം. അതായത് എൻഎഡിഎച്ച് പോലുള്ള ഇലക്ട്രോൺ ദാതാക്കളിൽ നിന്നും ഓക്സിജൻ പോലെയുള്ള ഇലക്ട്രോണൻ സ്വീകർത്താക്കളിലൂടെ എക്സെർഗോണിക് പ്രക്രിയയിലൂടെ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിൻ വഴി ഇലക്ട്രോൺ പ്രവാഹമുണ്ടാകുന്നു. അതു ഊർജ്ജം പുറത്തേയ്ക്കു വിടുന്നു. എന്നാൽ എ.ടി.പി സിന്തസിസ് ഒരു എൻഡർഗോണിക് പ്രക്രിയയാണ്. ഇതിന് ഊർജ്ജം നൽകേണ്ടതുണ്ട്. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയും എ.ടി.പി സിന്തേസും ഒരു സ്തരത്തിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിനിൽ നിന്ന് എ.ടി.പി സിന്തേസിലേക്ക് കോശസ്തരങ്ങളിലുടനീളം പ്രോട്ടോണുകളുടെ ചലനങ്ങൾ വഴി ഊർജ്ജം കൈമാറുന്നു. ഈ പ്രക്രിയയെ കെമിയോസ്മോസിസ് എന്നു വിളിക്കുന്നു.[7]
പ്രായോഗികമായി, ഇത് ഒരു ലളിതമായ വൈദ്യുത വലയം പോലെയാണ്. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിന്റെ പ്രോട്ടോൺ-പമ്പിങ് എൻസൈമുകൾ മുഖേന നെഗറ്റീവ് N-സൈഡിലെ കോശസ്തരങ്ങളിൽ നിന്നും പോസിറ്റീവ് പി-സൈഡിലേക്ക് നയിക്കുന്നു. ഈ എൻസൈമുകൾ ഒരു ബാറ്ററി പോലെയാണ്. സർക്യൂട്ട് വഴി വൈദ്യൂതി കടത്തിവിടുന്നതിലേയ്ക്കായി ഇത് പ്രവർത്തിക്കുന്നു. പ്രോട്ടോണുകളുടെ ചലനം ഒരു കോശസ്തരങ്ങളിലൂടെ ഇലക്ട്രോകെമിക്കൽ ഗ്രേഡിയന്റ് സൃഷ്ടിക്കുന്നു. ഇത് പ്രോട്ടോൺ-പ്രേരണ ശക്തി എന്ന് അറിയപ്പെടുന്നു. ഇതിന് രണ്ട് ഘടകങ്ങളുണ്ട്: N-സൈഡ് നെഗറ്റീവ് ചാർജ്ജാകുമ്പോൾ പ്രോട്ടോൺ കോൺസെട്രേഷനിലും (H + ഗ്രേഡിയൻറ്, Δഎച്ച്) ഇലക്ട്രിക് പൊട്ടൻഷ്യലിലും വ്യത്യാസവും ഉണ്ടാകുന്നു.[8]
സർക്യൂട്ട് പൂർത്തിയാക്കുന്നതോടെ എ.ടി.പി സിന്തേസ് സംഭരണ ഊർജ്ജത്തെ സ്വതന്ത്രമാക്കുന്നതോടെ പ്രോട്ടോണുകളുടെ പ്രവാഹം സുഗമമാകുകയും ഇലക്ട്രൊകെമിക്കൽ ഗ്രേഡിയൻറ് താഴുകയും കോശസ്തരങ്ങളിലെ N-സൈഡിലേയ്ക്ക് മടങ്ങുകയും ചെയ്യുന്നു.[9] ഇലക്ട്രോകെമിക്കൽ ഗ്രേഡിയന്റ് എൻസൈം ഘടനയുടെ ഭാഗത്തിന്റെ ഭ്രമണം ചെയ്യുകയും ഈ ചലനങ്ങൾ എ.ടി.പിയുടെ നിർമ്മാണത്തിലേയ്ക്ക് സമന്വയിപ്പിക്കുകയും ചെയ്യുന്നു.
പ്രോട്ടോൺ-പ്രേരണ ശക്തിയുടെ രണ്ട് ഘടകങ്ങൾ താപഗതികമായി തുല്യമാണ്: മൈറ്റോകോണ്ട്രിയയിൽ, ഊർജ്ജത്തിന്റെ വലിയ ഭാഗം പൊട്ടൻഷ്യലിന് വഴിതെളിക്കുന്നു. ആൽക്കലിഫൈൽ ബാക്ടീരിയയിൽ വൈദ്യുതോർജ്ജം വിപരീത ദിശയിൽ പി.എച്ച് വ്യത്യാസത്തിന് കാരണമായിതീരുകയും ചെയ്യുന്നു. പ്രൊപ്പിയോണിയേനിയം മോഡേസ്റ്റം എന്ന ഫ്യൂസോബാക്ടീരിയത്തിനെ എടുക്കുകയാണെങ്കിൽ അത് ഉപയൂണീറ്റുകളുടെ എ.ടി.പി സിന്തേസിലെ FO മോട്ടോറിൻറെ ഒരു കൗണ്ടർ-റൊട്ടേഷൻ a, c എന്നിവയിലേയ്ക്കു നയിക്കുന്നു.[8]
ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ പുറത്തുവിടുന്ന ഊർജ്ജത്തിൻറെ അളവ് അനെയ്റോബിക് ഫെർമെൻറേഷൻ വഴി പുറത്തുവിടുന്നതിനേക്കാൾ വളരെ ഉയർന്നതാണ്. ഗ്ലൈക്കോളിസിസ് വഴി 2 ATP തന്മാത്രകൾ മാത്രമേ ഉൽപാദിപ്പിക്കുന്നുള്ളൂ. എന്നാൽ 30-നും 36-നും ഇടയ്ക്കുള്ള ATP- കൾ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷനു കാരണമായിതീരുകയും അതിലെ 10 NADH ഉം 2 തന്മാത്രകളും ഗ്ലൂക്കോസിൻറെ ഒരു തന്മാത്രയെ കാർബൺ ഡൈ ഓക്സൈഡും ജലവും ആക്കി മാറ്റുന്നു.[10] ഒരു ഫാറ്റി ആസിഡിന്റെ ഓരോ ബീറ്റാ ഓക്സിഡേഷൻ ചക്രത്തിലും 14 ATP ലഭിക്കുന്നു. സൈദ്ധാന്തികപരമായി ഈ ATP പരമാവധി ലഭിക്കുന്ന സംഖ്യയാണ്. പ്രായോഗികമായി, ഏതാനും പ്രോട്ടോണുകൾ കോശസ്തരങ്ങളുടെ പുറത്തേയ്ക്ക് ചോർന്നുപോകുകയും ATP ലഭിക്കുന്നത് കുറയുകയും ചെയ്യുന്നു.[11]
ഇലക്ട്രോൺ, പ്രോട്ടോൺ ട്രാൻസ്ഫർ തന്മാത്രകൾ
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: കോഎൻസൈം, കോഫാക്ടർ (ജൈവരസതന്ത്രം)
ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിൻ പ്രോട്ടോണുകളും ഇലക്ട്രോണുകളും വഹിക്കുന്നു, പ്രോട്ടോണുകൾ കോശസ്തരങ്ങളിൽ എത്തിക്കുകയും ദാതാവിൽ നിന്നും സ്വീകർത്താക്കളിലേക്ക് ഇലക്ട്രോണുകൾ കടന്നുപോകുകയും ചെയ്യുന്നു. ഈ പ്രക്രിയകൾ ലയിക്കുന്ന പ്രോട്ടീൻ-ബന്ധിത ട്രാൻസ്ഫർ തന്മാത്രകളിലും ഉപയോഗിക്കുന്നു. മൈറ്റോകോണ്ട്രിയയിൽ, ജലത്തിൽ ലയിക്കുന്ന ഇലക്ട്രോൺ ട്രാൻസ്ഫർ പ്രോട്ടീൻ സൈറ്റോക്രോം സി ഉപയോഗിച്ച് ഇലക്ട്രോണുകൾ കോശസ്തരങ്ങളിലെ ഇടയിലുള്ള സ്ഥലത്തേയ്ക്ക് മാറ്റുന്നു.[12] ഇത് ഇലക്ട്രോണുകളെ മാത്രമേ വഹിക്കുന്നുള്ളു. ഇരുമ്പ് ആറ്റത്തിൻറെ ഓക്സീഡേഷൻ, റിഡക്ഷൻ രാസപ്രവർത്തനത്തിലൂടെ ഇലക്ട്രോണുകൾ കൈമാറ്റം ചെയ്യുന്നതിനാൽ അതിന്റെ ഘടനയിൽ ഒരു ഹെമി ഗ്രൂപ്പിനുള്ളിൽ പ്രോട്ടീൻ നിലനിർത്തുന്നു. ചില ബാക്ടീരിയകളിൽ സൈറ്റോക്രോം സി കണ്ടെത്തിയിട്ടുണ്ട്. പെരിപ്ലാസ്മിക് സ്പേസിൽ ഇത് സ്ഥിതിചെയ്യുന്നു.[13]
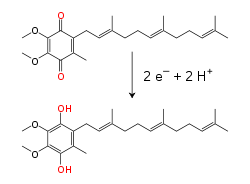
ഒരു റിഡോക്സ് ചക്രം വഴി അകത്തെ മൈറ്റോകോണ്ട്രിയൽ കോശസ്തരത്തിനുള്ളിൽ ലിപിഡ്-സോലുബിൾ ഇലക്ട്രോൺ കാരിയർ കോഎൻസൈം ക്യു 10 (Q) ഇലക്ട്രോണുകളെയും പ്രോട്ടോണുകളെയും വഹിക്കുന്നു.[14] ഈ ചെറിയ ബെൻസോക്വിനോൺ തന്മാത്രകൾ വളരെ ഹൈഡ്രോഫോബിക് ആണ്. അതിനാൽ അത് കോശസ്തരത്തിൽ സ്വതന്ത്രമായി വ്യാപിക്കുന്നു. രണ്ട് ഇലക്ട്രോണുകളും രണ്ട് പ്രോട്ടോണുകളും Q സ്വീകരിക്കുമ്പോൾ, ഇത് റിഡക്ഷനിലൂടെ യൂബിക്വിനോൾ രൂപത്തിലേക്ക് (QH2) മാറുന്നു; QH2 രണ്ട് ഇലക്ട്രോണുകളും രണ്ട് പ്രോട്ടോണുകളും പുറത്തുവിടുമ്പോൾ, ഓക്സീകരണത്തിലൂടെ അത് യൂബിക്വിനോൺ (Q) രൂപത്തിലേക്ക് മാറുന്നു. അതിന്റെ ഫലമായി, രണ്ട് എൻസൈമുകൾ കോശസ്തരത്തിൻറെ ഒരുവശത്ത് Q വിന് റിഡക്ഷനും QH2 വിന് ഓക്സിഡേഷനും സംഭവിക്കുന്നു. യൂബിക്വിനോൺ ഈ രാസപ്രവർത്തനങ്ങളെ യോജിപ്പിക്കുകയും പ്രോട്ടോണിനെ കോശസ്തരത്തിൽ മുന്പോട്ടും പിറകോട്ടും ചലിപ്പിക്കുന്നു.[15] ചില ബാക്ടീരിയൽ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലകൾ മെനാക്വിനോൺ, യൂബിക്വിനോൺ തുടങ്ങിയ വ്യത്യസ്ത ക്വിനോണുകൾ ഉപയോഗിക്കുന്നു.[16]
പ്രോട്ടീനുകൾക്കുള്ളിൽ ഇലക്ട്രോണുകൾ ഫ്ലേവിൻ കോഫാക്ടറുകൾ, ഇരുമ്പ് സൾഫർ ക്ലസ്റ്ററുകൾ, സൈട്ടോക്രോമുകൾ, എന്നിവക്കിടയിൽ കൈമാറ്റം ചെയ്യപ്പെടുന്നു.[17][18] അവിടെ പല തരത്തിലുള്ള ഇരുമ്പ് സൾഫർ ക്ലസ്റ്റർ ഉണ്ട്. ഏറ്റവും ലളിതമായ ഇനം ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ചെയിനിൽ രണ്ട് അകാർബണിക സൾഫറിന്റെ ആറ്റങ്ങളോടൊപ്പം രണ്ട് ഇരുമ്പ് ആറ്റങ്ങളും ചേരുന്നു. ഇവയെ [2Fe-2S] ക്ലസ്റ്ററുകൾ എന്ന് വിളിക്കുന്നു. രണ്ടാം തരം, [4Fe-4S] നാല് ഇരുമ്പ് ആറ്റങ്ങളും നാല് സൾഫർ ആറ്റങ്ങളും ഉള്ള ഒരു ക്യൂബ് അടങ്ങിയിട്ടുണ്ട്. സാധാരണയായി സിസ്റ്റീൻറെ ആറ്റത്തിൽ സൾഫർ ഈ ഗ്രൂപ്പുകളിലെ ഓരോ ഇരുമ്പ് ആറ്റത്തിനും ഒരു അമിനോ ആസിഡും കോർഡിനേറ്റു ചെയ്യപ്പെട്ടിരിക്കുന്നു. അങ്ങനെ ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ചെയിനിൽ ലോഹ അയോൺ കോഫാക്ടറുകൾ റിഡോക്സ് റിയാക്ഷന് വിധേയമാകുകയും പ്രോട്ടോണുകളെ യോജിപ്പിക്കുകയോ സ്വതന്ത്രമാക്കുകയോ ചെയ്യാതെ പ്രോട്ടീനുകൾ വഴി ഇലക്ട്രോണുകളെ കൊണ്ടുപോകാൻ മാത്രം അവ പ്രവർത്തിക്കുന്നു. ഈ കോഫാക്ടറുകളുടെ ചങ്ങലയ്ക്കരികിൽ ഇലക്ട്രോണുകൾ പ്രോട്ടീനുകളുടെ അടുത്തുനിന്നും വളരെ ദൂരത്തേയ്ക്ക് നീങ്ങുന്നു[19] 1.4 × 10-9 മീറ്റർ ദൂരം കുറവുള്ള വേഗതയിലുള്ള ക്വാണ്ടം ടണലിംഗിലാണ് ഇത് സംഭവിക്കുന്നത്.[20]
യൂക്കാരിയോട്ടിക്ക് ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലകൾ
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിൻ ആൻഡ് കെമിയോസ്മോസിസ്
ഗ്ലൈക്കോളിസിസ്, സിട്രിക് ആസിഡ് സൈക്കിൾ, ബീറ്റാ ഓക്സിഡേഷൻ തുടങ്ങി പല കാറ്റബോളിക് ബയോകെമിക്കൽ പ്രക്രിയകളിൽ റിഡക്ഷനിലൂടെ കോഎൻസൈം NADH ഉൽപാദിപ്പിക്കുന്നു. ഈ കോഎൻസൈമിൽ ഉയർന്ന പൊട്ടൻഷ്യലുള്ള ട്രാൻസ്ഫർ ഇലക്ട്രോണുകൾ അടങ്ങിയിരിക്കുന്നു. മറ്റൊരർത്ഥത്തിൽ പറഞ്ഞാൽ, ഓക്സീഡേഷൻ വഴി വലിയ തോതിൽ ഊർജ്ജം സ്വതന്ത്രമാക്കുന്നു. എന്നിരുന്നാലും, കോശം ഈ ഊർജ്ജത്തെ ഒന്നിച്ച് പുറത്തുവിടുകയില്ല, കാരണം ഇത് അനിയന്ത്രിതമായ രാസപ്രവർത്തനത്തിന് കാരണമാകുന്നു. പകരം, ഇലക്ട്രോണുകൾ NADH ൽ നിന്നും നീക്കംചെയ്യുകയും ഒരു എൻസൈം പരമ്പരയിലൂടെ ഓക്സിജൻ കടന്നുപോവുകയും ഓരോന്നും ചെറിയ ഊർജ്ജം സ്വതന്ത്രമാക്കുകയും ചെയ്യുന്നു. ഈ സെറ്റ് എൻസൈമുകളിൽ സംയുക്തം I മുതൽ IV വരെ ഉൾക്കൊള്ളുന്നു. ഇതിനെ ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ചെയിൻ എന്ന് വിളിക്കുന്നു. ഇത് മൈറ്റോകോട്രിയയുടെ കോശസ്തരങ്ങളുടെ ഉൾഭാഗത്ത് കാണപ്പെടുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയിൽ സക്സിനേറ്റ് ഓക്സീകരിക്കപ്പെടുകയും, പക്ഷേ വ്യത്യസ്ത ഘട്ടങ്ങളിലൂടെ പാതകൾ കടന്നുപോകുന്നു.
യൂക്കാരിയോട്ടുകളിൽ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് സിസ്റ്റത്തിലെ എൻസൈമുകൾ മൈറ്റോകോൺട്രിയയുടെ ഉൾഭാഗത്ത് പ്രോട്ടോണുകൾ പമ്പ് ചെയ്യുന്നതിന് NADH ഓക്സീകരണത്തിൽ നിന്നും പുറപ്പെടുവിക്കുന്ന ഊർജ്ജം ഉപയോഗിക്കുന്നു. ഇത് കോശസ്തരങ്ങൾക്കിടയിൽ പ്രോട്ടോണുകളെ സൃഷ്ടിക്കാൻ കാരണമാകുന്നു. കൂടാതെ കോശസ്തരങ്ങൾക്കിടയിൽ ഒരു ഇലക്ട്രോകെമിക്കൽ ഗ്രേഡിയൻറ് സൃഷ്ടിക്കുന്നു. സംഭരിച്ചിട്ടുള്ള ഈ ഊർജ്ജം ATP സിന്തേസ് ഉപയോഗിച്ച് ATP ഉത്പ്പാദിപ്പിക്കുന്നു. യൂക്കാരിയോട്ടിക് മൈറ്റോകോട്രിയയിലെ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ ആണ് ഈ പ്രക്രിയയ്ക്ക് ഏറ്റവും നന്നായി മനസ്സിലാക്കപ്പെട്ട ഉദാഹരണം. . Trichomonas vaginalis പോലുള്ള അനെയ്റോബിക് പ്രോട്ടോസോവ ഒഴികെ മിക്കവാറും എല്ലാ യൂക്കാരിയോട്ടുകളിൽ മൈറ്റോൺകോട്രിയ കാണപ്പെടുന്നു. പകരം ഇത് പ്രോട്ടോണുകളെ ഹൈഡ്രജനിൽ നിന്നും റിഡക്ഷൻ നടത്തുകയും ശേഷിക്കുന്ന മൈറ്റോകോൺട്രിയയെ ഹൈഡ്രോജിനോസോം എന്നു വിളിക്കുന്നു.[21]
| ശ്വാസകോശ രാസാഗ്നി | റെഡോക്സ് ജോഡി | Midpoint potential
(Volts) |
|---|---|---|
| NADH ഡിഹൈഡ്രോജിനേസ് | NAD+ / NADH | −0.32[22] |
| സക്സിനേറ്റ് ഡിഹൈഡ്രോജിനേസ് | FMN or FAD / FMNH2 or FADH2 | −0.20[22] |
| സൈറ്റോക്രോം bc1 സംയുക്തം | കോഎൻസൈം Q10ox / Coenzyme Q10red | +0.06[22] |
| സൈറ്റോക്രോം bc1 സംയുക്തം | സൈറ്റോക്രോം box / സൈറ്റോക്രോം bred | +0.12[22] |
| സംയുക്തം IV | സൈറ്റോക്രോം cox / സൈറ്റോക്രോം cred | +0.22[22] |
| സംയുക്തം IV | സൈറ്റോക്രോം aox / സൈറ്റോക്രോം ared | +0.29[22] |
| സംയുക്തം IV | O2 / HO− | +0.82[22] |
| Conditions: pH = 7[22] | ||
NADH-കോഎൻസൈം Q ഓക്സിഡോറിഡക്ടേസ് (സംയുക്തം I)
[തിരുത്തുക]
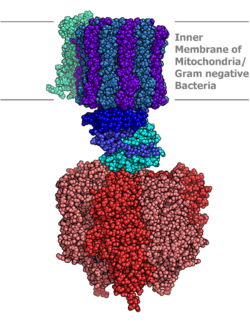
കോഎൻസൈം Q ഓക്സിഡോറിഡക്ടേസ് NADH ഡൈഹൈഡ്രോജിനേസ് അല്ലെങ്കിൽ സംയുക്തം I എന്നറിയപ്പെടുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ചെയിനിലെ ആദ്യത്തെ പ്രോട്ടീൻ ആണ് ഇത്.[23] ഭീമൻ എൻസൈം ആയ സംയുക്തം I നോടൊപ്പം ഉള്ള സസ്തനികളിലെ സംയുക്തം I ന് 46 ഉപയൂണീറ്റുകളും 1,000 കി.ഡാൽട്ടൻസ് (kDa) തന്മാത്ര പിണ്ഡവും കാണപ്പെടുന്നു.[24] ഒരു ബാക്ടീരിയമിൽ നിന്നുമാത്രം ഈ ഘടന വിശദമായി അറിയപ്പെടുന്നു.[25][26] കോശസ്തരത്തിൽ നിന്നും മൈറ്റോകോൺട്രിയയിലേക്ക് പുറത്തുവിടുന്ന ഒരു വലിയ "ബോൾ" പോലുള്ള സംയുക്തം മിക്ക ജീവജാലങ്ങളിലും സാമ്യത കാണുന്നു.[27][28] വ്യക്തിഗത പ്രോട്ടീനുകൾ എൻകോഡ് ചെയ്തിരിക്കുന്ന ജീനുകളിൽ കോശമർമ്മവും മൈറ്റോകോൺട്രിയൽ ജിനോമും മൈറ്റോകോൺട്രിയയിൽ അടങ്ങിയിട്ടുള്ള മറ്റു എൻസൈമുകളുടെയും അവസ്ഥ ഒരു പോലെയാണ്.
NADH ൻറെ രണ്ട് ഇലക്ട്രോൺ ഓക്സിഡേഷൻ സംഭവിക്കുമ്പോഴുണ്ടാകുന്ന എൻസൈം ആയ കോഎൻസൈം Q10 അഥവാ യൂബിക്വിനോൺ ഈ രാസപ്രക്രിയയ്ക്ക് ഊർജ്ജം നല്കുന്ന ഉൾപ്രേരകമായി പ്രവർത്തിക്കുന്നു.(താഴെയുള്ള സമവാക്യത്തിൽ Q എന്ന രീതിയിൽ പ്രതിനിധാനം ചെയ്യുന്നു) മൈറ്റോകോൺട്രിയ കോശസ്തരത്തിൽ കാണപ്പെടുന്ന ലിപിഡിൽ ലയിക്കുന്ന ക്വിനോൺ:
-
(1)
രാസപ്രവർത്തനത്തിൻറെ ആരംഭത്തിൽ, മുഴുവൻ ഇലക്ട്രോൺ ശൃംഖലയിൽ, NADH തന്മാത്ര യോജിച്ച് സംയുക്തം I ലേക്ക് രണ്ട് ഇലക്ട്രോണുകളെ നൽകുന്നു. ഫ്ലേവിൻ മോണോന്യൂക്ലിയോടൈഡ് (FMN) സംയുക്തങ്ങളുടെ ഒരു പ്രോസ്തെറ്റിക് ഗ്രൂപ്പ് വഴി ഇലക്ട്രോണുകൾ സംയുക്തം I ലേക്ക് പ്രവേശിക്കുന്നു. FMN ന് ഇലക്ട്രോണുകളുടെ കൂട്ടിച്ചേർക്കൽ FMNH2 എന്ന ചുരുക്ക രൂപത്തിലേക്ക് അതിനെ മാറ്റുന്നു. ഇലക്ട്രോണുകൾ പിന്നീട് ഇരുമ്പ്-സൾഫർ ക്ലസ്റ്ററുകളിലൂടെയാണ് കൈമാറ്റം ചെയ്യപ്പെടുന്നത്. രണ്ട് തരം പ്രോസ്തെറ്റിക് ഗ്രൂപ്പുകൾ സംയുക്തത്തിൽ കാണപ്പെടുന്നു.[25] സംയുക്തം I ൽ രണ്ട് [2Fe–2S], [4Fe–4S] ഇരുമ്പ് സൾഫർ ക്ലസ്റ്ററുകൾ കാണപ്പെടുന്നു.
ഇലക്ട്രോണുകൾ ഈ സംയുക്തത്തിലൂടെ കടന്നു പോകുമ്പോൾ നാലു പ്രോട്ടോണുകൾ മാട്രിക്സിൽ നിന്നും കോശസ്തരങ്ങൾക്കിടയിലുള്ള സ്ഥലത്തേക്ക് പമ്പ് ചെയ്യപ്പെടുന്നു. കൃത്യമായി ഇത് എങ്ങനെ സംഭവിക്കുന്നു എന്നത് വ്യക്തമല്ല, പക്ഷേ ഇത് സംയുക്തം I ലെ മാറ്റങ്ങളുമായി ബന്ധപ്പെട്ടവയാണെന്ന് കരുതുന്നു. ഇത് പ്രോട്ടീൻ കോശസ്തരത്തിന്റെ N-സൈഡിലെ പ്രോട്ടോണുകളുമായി ബന്ധിപ്പിക്കുകയും കോശസ്തരത്തിന്റെ P-സൈഡ് അവയെ സ്വതന്ത്രമാക്കുകയും ചെയ്യുന്നു.[29] ഒടുവിൽ ഇരുമ്പ് സൾഫർ ക്ലസ്റ്ററുകളുടെ ശൃംഖലയിൽ നിന്ന് കോശസ്തരങ്ങളിലെ യൂബിക്വിനോൺ തന്മാത്രയിൽ ഇലക്ട്രോണുകൾ കൈമാറുന്നു.[23] യൂബിക്വിനോണിന് റിഡക്ഷൻ സംഭവിക്കുമ്പോൾ ഒരു പ്രോട്ടോൺ ഗ്രേഡിയന്റ് തലമുറയെ സംഭാവന ചെയ്യുന്നു. രണ്ട് പ്രോട്ടോണുകൾ മാട്രിക്സിൽ നിന്ന് എടുക്കുന്നതിനാൽ യൂബിക്വിനോൺ (QH2) റിഡക്ഷൻ സംഭവിക്കുന്നു.
സക്സിനേറ്റ്- Q ഓക്സിഡോറിഡക്ടേസ് (സംയുക്തം II)
[തിരുത്തുക]
സക്സിനേറ്റ്- Q ഓക്സിഡോറിഡക്ടേസ് സംയുക്തം II അല്ലെങ്കിൽ സക്സിനേറ്റ് ഡൈഹൈഡ്രോജിനേസ് എന്നും അറിയപ്പെടുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയുടെ രണ്ടാമത്തെ പ്രവേശന പോയിന്റ് ആണിത്.[30] ഇത് അസാധാരണമാണ് കാരണം സിട്രിക് ആസിഡ് സൈക്കിൾ, ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ചെയിൻ എന്നിവയുടെ ഭാഗമായ ഒരേ ഒരു എൻസൈം ആണിത്. സംയുക്തം II നാല് പ്രോട്ടീൻ സബ് യൂണീറ്റുകൾ ഉൾക്കൊള്ളുന്നു. ഇതിൽ ഒരു ഫ്ലേവിൻ അഡിനീൻ ഡൈന്യൂക്ലിയോടൈഡ് (FAD) കോഫാക്ടർ, ഇരുമ്പ് സൾഫർ ക്ലസ്റ്ററുകൾ, ഒരു ഹെമി ഗ്രൂപ്പ് എന്നിവയും അടങ്ങിയിരിക്കുന്നു. ഹെമി ഗ്രൂപ്പ് കോഎൻസൈം Q ലേക്ക് ഇലക്ട്രോൺ ട്രാൻസ്ഫറിൽ പങ്കെടുക്കുന്നില്ല. എന്നാൽ ഇത് പ്രവർത്തിക്കുന്ന ഓക്സിജൻ ഇനങ്ങളുടെ ഉൽപാദനത്തിൽ കുറവുണ്ടാകുന്നതായി കരുതപ്പെടുന്നു.[31][32] ഇത് ഓക്സിഡൈസേഷൻ വഴി സക്സിനേറ്റിനെ ഫ്യുമറേറ്റ് ആയി മാറ്റുകയും യൂബിക്വിനോൺ റിഡക്ഷന് വിധേയമാകുകയും ചെയ്യുന്നു. NADH ന് ഓക്സിഡേഷൻ സംഭവിക്കുമ്പോൾ സ്വതന്ത്രമാക്കുന്ന ഊർജ്ജത്തെക്കാൾ വളരെക്കുറച്ച് ഊർജ്ജം മാത്രമേ ഈ രാസപ്രവർത്തനത്തിൽ പുറത്തുവിടുന്നുള്ളൂ. സംയുക്തം II, കോശസ്തരത്തിൽ പ്രോട്ടോണുകളെ കടത്തിവിടുന്നില്ലെന്നു മാത്രമല്ല പ്രോട്ടോൺ ഗ്രേഡിയൻറ് സൃഷ്ടിക്കുന്നുമില്ല.
-
(2)
പരാദവിരയായ നാടവിര (Ascaris suum) പോലുള്ള ചില യൂക്കാരിയോട്ടുകളിൽ, സംയുക്തം II വിന് സമാനമായ ഒരു എൻസൈം, ഫ്യൂമറേറ്റ് റിഡക്ടേസ് (മെനാക്വിനോൾ: ഫ്യൂമറേറ്റ് ഓക്സിഡോറിഡക്ടേസ്, അല്ലെങ്കിൽ QFR), എതിരായി പ്രവർത്തിച്ച് യൂബിക്വിനോണിനെ ഓക്സിഡൈസ് ചെയ്യുകയും ഫ്യൂമറേറ്റ് റിഡക്ഷന് വിധേയമാകുകയും ചെയ്യുന്നു. ഇത് വൻകുടലിൽ ഓക്സിജൻ ലഭ്യമല്ലാത്ത ചുറ്റുപാടിൽ പരാദത്തിനെ വളരാൻ സഹായിക്കുന്നു. അനെയ്റോബിക് ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ സംഭവിക്കുകയും ഫ്യൂമെറേറ്റ് ഇലക്ട്രോൺ സ്വീകർത്താവായി മാറുകയും ചെയ്യുന്നു.[33] സംയുക്തം II വിൻറെ പാരമ്പര്യബന്ധമില്ലാത്ത മറ്റൊരു പ്രവർത്തനം മലമ്പനി പാരസൈറ്റായ പ്ലാസ്മോഡിയം ഫാൽസിപറമിലാണ് കാണപ്പെടുന്നത്. ഇവിടെ സംയുക്തം II വിന് വിപരീത പ്രവർത്തനം ആണ് സംഭവിക്കുന്നത്. യൂബിക്വിനോൾ പുനഃസ്ഥാപിക്കുന്നതിൽ ഓക്സിഡേസ് വളരെ പ്രധാനമാണ്. ഇവിടെ പാരസൈറ്റ് അസാധാരണ രൂപത്തിലുള്ള പിരിമിഡിൻ ബയോസിന്തസിസ് ആണ് ഉപയോഗിക്കുന്നത്.[34]
ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ഫ്ളാവോപ്രോട്ടീൻ- Q ഓക്സിഡോറിഡക്ടേസ്
[തിരുത്തുക]ഇലക്ട്രോൺ ട്രാൻസ്ഫർ ഫ്ളാവോപ്രോട്ടീൻ -യൂബിക്വിനോൺ ഓക്സിഡോറിഡക്ടേസ് (ETF-Q ഓക്സിഡോറിഡക്ടേസ്) ഇലക്ട്രോൺ ട്രാൻസ്ഫറിംഗ് ഫ്ളാവോപ്രോട്ടീൻ ഡൈഹൈഡ്രോജിനേസ് എന്നും അറിയപ്പെടുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയുടെ മൂന്നാം പ്രവേശന പോയിന്റ് ആണിത്. മൈറ്റോകോണ്ട്രിയൽ മാട്രിക്സിലെ ഇലക്ട്രോൺ-ട്രാൻസ്ഫെറിംഗ് ഫ്ളാവോപ്രോട്ടീനിൽ നിന്ന് ഇലക്ട്രോൺ സ്വീകരിക്കുന്ന ഒരു എൻസൈം ആണ് ഇത്- യൂബിക്വിനോണിനെ റിഡക്ഷന് വിധേയമാക്കാൻ ഈ ഇലക്ട്രോണുകൾ ഉപയോഗിക്കുന്നു.[35] ഈ എൻസൈമിൽ ഫ്ലേവിനും ഒരു [4Fe-4S] ക്ലസ്റ്ററും അടങ്ങിയിരിക്കുന്നു. എന്നാൽ, മറ്റു ശ്വസനസംയുക്തങ്ങളിൽ നിന്നു വ്യത്യസ്തമായി, ഇത് ലിപിഡ് കൊണ്ടുള്ള രണ്ടു പാളികളെ മറികടക്കാതെ കോശസ്തരങ്ങളുടെ ഉപരിതലത്തിലേക്ക് ചേർക്കുകയും ചെയ്യുന്നു.[36]
-
(3)
സസ്തനികളിൽ, ഈ ഉപാപചയ വഴി മൾട്ടിപ്പിൾ അസെറ്റൈൽ- CoA ഡീഹൈഡ്രോജിനേസുകളിൽ നിന്ന് ഇലക്ട്രോണുകൾ സ്വീകരിക്കുന്നതിനാൽ ഫാറ്റി ആസിഡുകളുടെ ബീറ്റാ ഓക്സിഡേഷൻ, അമിനോ ആസിഡുകളുടെ കാറ്റബോളിസം, കോളിൻ എന്നിവ പ്രധാനമാണ്.[37][38] സസ്യങ്ങളിൽ, ETF-Q ഓക്സിഡോറിഡക്ടേസ് ഉപാപചയ പ്രതികരണങ്ങളിൽ പ്രധാനമാണ്. ഇരുണ്ട ദീർഘകാലഘട്ടങ്ങളിൽ അതിജീവിക്കാൻ ഇത് സഹായിച്ചിരുന്നു.[39]
Q-സൈറ്റോക്രോം c ഓക്സിഡോറിഡക്ടേസ് (സംയുക്തം III)
[തിരുത്തുക]
Q-സൈറ്റോക്രോം c ഓക്സിഡോറിഡക്ടേസ് സൈറ്റോക്രോം c റിഡക്ടേസ്, സൈറ്റോക്രോം bc1 സംയുക്തം അല്ലെങ്കിൽ ലഘുവായി സംയുക്തം III എന്നും അറിയപ്പെടുന്നു,[40][41] സസ്തനികളിൽ, ഈ എൻസൈം ഡൈമർ ആണ്. ഓരോ സബ് യൂണീറ്റ് സംയുക്തങ്ങളിലും 11 പ്രോട്ടീൻ സബ് യൂണീറ്റുകൾ . ഒരു [2Fe-2S] ഇരുമ്പ് സൾഫർ ക്ലസ്റ്റർ, മൂന്ന് സൈറ്റൊക്രോമുകൾ: ഒരു സൈറ്റോക്രോം c1, രണ്ട് b സൈറ്റൊക്രോമുകൾ എന്നിവ അടങ്ങിയിരിക്കുന്നു.[42] സൈറ്റോക്രോം ഒരു ഹെമി ഗ്രൂപ്പെങ്കിലും അടങ്ങിയിരിക്കുന്ന ഇലക്ട്രോൺ ട്രാൻസ്ഫർ പ്രോട്ടീൻ പോലെയാണ്. സംയുക്തം III നകത്തുള്ള ഹെമി ഗ്രൂപ്പുകളിലെ അയേൺ ആറ്റങ്ങൾ ഒന്നിടവിട്ട് ഫെറസ് (+2) റിഡക്ഷന് വിധേയമാകുകയും ഫെറിക് (+3) ഓക്സിഡൈസ് ചെയ്യുകയും ഇലക്ട്രോണുകൾ പ്രോട്ടീൻ വഴി കൈമാറ്റം ചെയ്യപ്പെടുകയും ചെയ്യുന്നു.
ഉൾപ്രേരകം ഉപയോഗിച്ച് രാസപ്രവർത്തനത്തെ ത്വരിതപ്പെടുത്തുമ്പോൾ യൂബിക്വിനോളിൻറെ ഒരു തന്മാത്രയ്ക്ക് ഓക്സിഡേഷൻ സംഭവിക്കുമ്പോൾ സംയുക്തം III ആകുന്നു. സൈറ്റോക്രോം c യുടെ രണ്ട് തന്മാത്രകൾ റിഡക്ഷന് വിധേയമാകുകയും മൈറ്റോകോണ്ട്രിയോണുമായി ബന്ധപ്പെട്ട ഒരു ഹെമി പ്രോട്ടീൻ ചേർച്ചയില്ലാത്ത രീതിയിൽ ബന്ധപ്പെട്ടിരിക്കുന്നു. രണ്ട് ഇലക്ട്രോണുകൾ വഹിക്കുന്ന കോഎൻസൈം Q ൽ നിന്ന് വ്യത്യസ്തമായി സൈറ്റോക്രോം സി ഒരു ഇലക്ട്രോണിനെ മാത്രമേ വഹിക്കുന്നുള്ളൂ.
-
(4)
ഒരേ ഒരു ഇലക്ട്രോൺ മാത്രം QH2 ദാതാവിൽ നിന്ന് ഒരു സൈറ്റോക്രം c സ്വീകർത്താവിലേയ്ക്ക് ഒരേസമയം കൈമാറ്റം ചെയ്യാവുന്നതാണ്. സംയുക്തം III ൻറെ പ്രവർത്തനരീതി മറ്റ് ശ്വസന സംയുക്തങ്ങളെ അപേക്ഷിച്ച് കൂടുതൽ വിശാലമാണ്. Q ചക്രം എന്ന് വിളിക്കപ്പെടുന്ന രണ്ട് ഘട്ടങ്ങളിലാണ് ഇത് സംഭവിക്കുന്നത്[43] ആദ്യ ഘട്ടത്തിൽ, എൻസൈം മൂന്ന് സബ്സ്ട്രാറ്റുകളെ ബന്ധിപ്പിക്കുന്നു. ആദ്യം QH2 ഓക്സീഡൈസ് ചെയ്യപ്പെടുകയും രണ്ടാമത്തെ പ്രോട്ടീൻ ആയ സൈറ്റോക്രോം c യിലേക്ക് ഒരു ഇലക്ട്രോൺ കടന്നുപോകുകയും ചെയ്യുന്നു. QH2 വിൽ നിന്ന് സ്വതന്ത്രമാകുന്ന രണ്ട് ഇലക്ട്രോണുകൾ കോശസ്തരങ്ങൾക്കിടയിലുള്ള സ്പേസിലേയ്ക്ക് കടക്കുന്നു. മൂന്നാമത്തെ പ്രോട്ടീൻ Q രണ്ടാമത്തെ ഇലക്ട്രോൺ QH2വിൽ നിന്ന് സ്വീകരിക്കുകയും തുടർന്ന് റിഡക്ഷന് വിധേയമാകുകയും Q.− ആയിതീരുകയും ചെയ്യുന്നു. ഇത് യുബിസെമിക്വിനോൺ ഫ്രീ റാഡിക്കലാണ്. ആദ്യത്തെ രണ്ട് സബ്സ്ട്രേറ്റുകൾ സ്വതന്ത്രമാകുന്നുണ്ടെങ്കിലും ഇത് യുബിസെമിക്വിനോൺ ഇന്റർമീഡിയറ്റ് ബന്ധിതമായി അവശേഷിക്കുന്നു. രണ്ടാം ഘട്ടത്തിൽ QH2വിന്റെ രണ്ടാമത്തെ തന്മാത്ര യോജിക്കുകയും ഇതിൻറെ ആദ്യത്തെ ഇലക്ട്രോൺ സൈറ്റോക്രോം c യിലേയ്ക്ക് കടക്കുന്നു. രണ്ടാമത്തെ ഇലക്ട്രോൺ യുബിസെമിക്വിനോണിലൂടെ ബന്ധിച്ച് കടന്നുപോകുന്നു. അതിനെ റിഡക്ഷനിലൂടെ QH2 ആകുകയും മൈറ്റോകോണ്ട്രിയൽ മാട്രിക്സിൽ നിന്ന് രണ്ട് പ്രോട്ടോണുകൾ നേടുകയും ചെയ്യുന്നു. ഈ QH2 പിന്നീട് എൻസൈമിൽ നിന്ന് സ്വതന്ത്രമാക്കുന്നു.[44]
കോശസ്തരങ്ങൾക്കകത്ത് വശങ്ങളിലുള്ള യുബിക്വിനോൾ കോഎൻസൈം Q വിന്റെ സഹായത്തോടെ റിഡക്ഷന് വിധേയമാകുകയും യുബിക്വിനോൺ ആയി ഓക്സിഡൈസ് ചെയ്യുകയും കോശസ്തരങ്ങളിലുടനീളം പ്രോട്ടോണുകളുടെ പ്രവാഹം സംഭവിക്കുകയും പ്രോട്ടോൺ ഗ്രേഡിയന്റിനൊപ്പം കൂട്ടിചേർക്കുകയും ചെയ്യുന്നു. പ്രോട്ടോൺ കൈമാറ്റത്തിന്റെ കാര്യക്ഷമത വർദ്ധിപ്പിക്കുന്നതിനാൽ ഇത് സംഭവിക്കുന്ന സംയുക്തങ്ങളുടെ രണ്ടാം-ഘട്ട സംവിധാനം വളരെ പ്രധാനമാണ്. Q സൈക്കിളിനുപകരം, QH2 ന്റെ ഒരു തന്മാത്ര സൈറ്റോക്രോം c യുടെ രണ്ട് തന്മാത്രകളെ നേരിട്ട് കുറയ്ക്കാൻ ഉപയോഗിക്കുന്നു. കാര്യക്ഷമത പകുതിയായി കുറയുകയും സൈറ്റോക്രോം c യിൽ ഒരു പ്രോട്ടോൺ മാത്രം കൈമാറ്റം ചെയ്യപ്പെടുകയും ചെയ്യുന്നു.[17]
സൈറ്റോക്രോം c ഓക്സിഡേസ് (സംയുക്തം IV)
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: സൈറ്റോക്രോം c ഓക്സിഡേസ്

സൈറ്റോക്രോം c ഓക്സിഡേസ് സംയുക്തം IV എന്നും അറിയപ്പെടുന്നു. ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയുടെ അന്തിമ പ്രോട്ടീൻ സംയുക്തം ആണ്.[45] സസ്തനികളിലുള്ള എൻസൈം വളരെ സങ്കീർണ്ണമായ ഒരു ഘടനയാണ്. ഇതിൽ 13 ഉപവിഭാഗങ്ങൾ, രണ്ട് ഹെമി ഗ്രൂപ്പുകൾ, അനവധി ലോഹ അയോൺ കോഫാക്ടേർസ് ഇവയിൽ എല്ലാം, കോപ്പർ മൂന്ന് ആറ്റങ്ങളും, ഒരു മഗ്നീഷ്യം ഒരു സിങ്കും കാണപ്പെടുന്നു.[46]
ഈ എൻസൈം ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയിലെ അന്തിമ രാസപ്രവർത്തനത്തിൽ മധ്യസ്ഥത വഹിക്കുകയും ഓക്സിജനു ഇലക്ട്രോണുകളെ കൈമാറ്റം ചെയ്യുകയും, അതേ സമയം കോശസ്തരങ്ങൾക്കു ചുറ്റും പ്രോട്ടോണുകൾ പമ്പ് ചെയ്യുന്നു.[47] അവസാന ഇലക്ട്രോൺ സ്വീകർത്താവായ ഓക്സിജൻ, ടെർമിനൽ ഇലക്ട്രോൺ സ്വീകർത്താവ് എന്നും വിളിക്കപ്പെടുന്നു, ഈ ഘട്ടത്തിൽ വെള്ളം കുറയ്ക്കുന്നു. ഈ ഘട്ടത്തിൽ ജലത്തിന് റിഡക്ഷൻ സംഭവിക്കുകയും ചെയ്യുന്നു. പ്രോട്ടോണുകളുടെ നേരിട്ടുള്ള പമ്പിംഗും മാട്രിക്സ് പ്രോട്ടോണുകളുടെ ഉപഭോഗം ഓക്സിജന് റിഡക്ഷൻ സംഭവിക്കുകയും പ്രോട്ടോൺ ഗ്രേഡിയന്റ് ഉണ്ടാകുകയും ചെയ്യുന്നു. സൈറ്റോക്രോം c ക്ക് ഓക്സിഡേഷൻ സംഭവിക്കുകയും ഓക്സിജന് റിഡക്ഷൻ സംഭവിക്കുകയും ചെയ്യുന്നു.
-
(5)
ആൾട്ടർണേറ്റീവ് റിഡക്ടേസെസ്, ഓക്സിഡേസെസ്
[തിരുത്തുക]ധാരാളം യൂക്കാരിയോട്ടിക്കുകളിൽ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖല കാണപ്പെടുന്നു. അത് മുകളിൽ വിശദമായി പഠിക്കുന്ന സസ്തനികളിലെ എൻസൈമുകളിൽ നിന്ന് വ്യത്യാസപ്പെട്ടിരിക്കുന്നു. ഉദാഹരണത്തിന്, സസ്യങ്ങൾക്ക് ആൾട്ടർണേറ്റീവ് NADH ഓക്സിഡേസെസ് കാണപ്പെടുന്നു. ഇത് മൈറ്റോകോണ്ട്രിയൽ മാട്രിക്സിനെക്കാൾ സൈറ്റോസോളിലെ NADH ഓക്സിഡൈസ് ചെയ്യുകയും ചെയ്യുന്നു. ഈ ഇലക്ട്രോണുകൾ യൂബിക്വിനോൺ കുളത്തിലൂടെ കടന്നുപോകുന്നു.[48] ഈ എൻസൈമുകൾ പ്രോട്ടോണുകൾ കൈമാറുന്നില്ല. അതിനാൽ, ആന്തരിക കോശസ്തരങ്ങളിലൂടെ ഇലക്ട്രോകെമിക്കൽ ഗ്രേഡിയന്റ് മാറ്റം സംഭവിക്കാതെ യൂബിക്വിനോൺ റിഡക്ഷന് വിധേയമാകുന്നു[49].
വിവിധ ദിശയിലേയ്ക്കുള്ള ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലക്ക് മറ്റൊരു ഉദാഹരണം ആൾട്ടർണേറ്റീവ് ഓക്സിഡേസെസ് ആണ്. സസ്യങ്ങളിൽ, ചില പൂപ്പൽ, പ്രോട്ടിസ്റ്റകൾ, ചില മൃഗങ്ങൾ എന്നിവയിൽ കാണപ്പെടുന്നു.[50][51] ഈ എൻസൈം യൂബിക്വിനോളിൽ നിന്ന് ഓക്സിജൻ നേരിട്ട് ഇലക്ട്രോണുകളെ കൈമാറുന്നു.[52]
ഈ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് പാത്ത്വേയിൽ ആൾട്ടർണേറ്റീവ് NADH, യൂബിക്വിനോൺ ഓക്സിഡേസെസ് എന്നിവയിൽ നിന്നും മുഴുവൻ പാത്ത്വേക്കാളിലും താഴ്ന്ന ATP ലഭിക്കുന്നു. ഒരു ഹ്രസ്വമായ പാത്ത്വേയിലൂടെയുള്ള ഗുണഫലങ്ങൾ പൂർണ്ണമായും വ്യക്തമല്ല. എന്നിരുന്നാലും, സ്ട്രെസ്സ്, കോൾഡ്, പ്രവർത്തനനിരതമായ ഓക്സിജൻ സ്പീഷീസുകൾ, രോഗസംക്രമകാരികൾ, മുഴുവൻ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയെ തടയുകയും ചെയ്യുന്ന മറ്റ് ഘടകങ്ങളും ആൾട്ടർണേറ്റീവ് ഓക്സിഡേസെസ് ഉത്പാദിപ്പിക്കുന്നു.[53][54] ആൾട്ടർണേറ്റീവ് പാത്ത്വേയിൽ ഓക്സിഡേറ്റീവ് സ്ട്രെസ്സ് കുറയ്ക്കുന്നതിലൂടെ ജീവികൾക്ക് മുറിവുകൾക്കെതിരെ പ്രതിരോധം വർദ്ധിപ്പിക്കാൻ സഹായിക്കുന്നു.[55]
ഓർഗനൈസേഷൻ ഓഫ് കോംപ്ലെക്സെസ്
[തിരുത്തുക]ശ്വസന ശൃംഖലകളുടെ സംയുക്തങ്ങൾ എങ്ങനെ സംഘടിപ്പിക്കാറുണ്ട് എന്നതിന്റെ യഥാർത്ഥ മാതൃകയിൽ അവ മൈറ്റോകോണ്ട്രിയൽ കോശസ്തരത്തിൽ സ്വതന്ത്രമായും വിന്യസിക്കുന്നു.[56] എന്നിരുന്നാലും, സമീപകാല വിവരങ്ങൾ പറയുന്നത് സംയുക്തങ്ങളുടെ ഉയർന്ന നിരയിലുള്ള ഘടനയെ സൂപ്പർ കോംപോക്സുകൾ അല്ലെങ്കിൽ റെസ്പിറസോംസ് എന്നു വിളിക്കുന്നു.[57] ഈ മാതൃകയിൽ, വിവിധ സംയുക്തങ്ങൾ പരസ്പരം പ്രവർത്തനം നടത്തുന്ന എൻസൈമുകളുടെ കൂട്ടങ്ങളായി സംഘടിച്ച് നിലനിൽക്കുന്നു.[58] ഈ അസോസിയേഷനുകൾ വിവിധ എൻസൈം സംയുക്തങ്ങൾക്കിടയിൽ സബ്സ്ട്രേറ്റുകൾക്ക് ചാനലുണ്ടാക്കുന്നു. ഇത് ഇലക്ട്രോൺ കൈമാറ്റനിരക്കിൻറെ കാര്യക്ഷമത വർദ്ധിപ്പിക്കുന്നു.[59] സസ്തനികളിലെ സൂപ്പർ സംയുക്തങ്ങളിൽ, ചില ഘടകങ്ങൾ മറ്റുള്ളവയെക്കാൾ ഉയർന്ന അളവിൽ ഉണ്ടായിരിക്കും. ഒന്നു മുതൽ നാലുവരെയുള്ള സംയുക്തങ്ങൾക്ക് ഇടയിലുള്ള അനുപാതം നിർണ്ണയിക്കുന്ന ചില ഡാറ്റകളിൽ ATP സിൻന്തേസ് ഏകദേശം 1: 1: 3: 7: 4 ആയിരിക്കും.[60] ഈ അസോസിയേഷനുകൾ വിവിധ എൻസൈം കോംപ്ലക്സുകൾക്ക് ചാനലുകൾ സൃഷ്ടിച്ചുകൊണ്ട് ഇലക്ട്രോൺ ട്രാൻസ്ഫറിന്റെ നിരക്ക്, കാര്യക്ഷമത എന്നിവ വർദ്ധിപ്പിക്കുന്നു.[61][62]
പ്രോകാരിയോട്ടിക്ക് ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലകൾ
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: മൈക്രോബിയൽ മെറ്റാബോളിസം
യൂകാരിയോട്ടുകൾ, ബാക്ടീരിയ, ആർക്കിയ, എന്നിവയിലെ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയുടെ ഘടനയിലും പ്രവർത്തനത്തിലും സാമാന്യ സമാനതയ്ക്ക് വിപരീതമായി, ഇലക്ട്രോൺ-ട്രാൻസ്ഫർ എൻസൈമുകളുടെ നിരവധി വൈവിധ്യങ്ങൾ കാണപ്പെടുന്നു. ഇത് സമാനമായ രാസപദാർത്ഥങ്ങളാണ് സബ്സ്ട്രേറ്റുകളായി ഉപയോഗിക്കുന്നത്.[63] യൂകാരിയോട്ടുകളോടൊപ്പം പൊതുവായി പ്രോകാരിയോട്ടിക്ക് ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ടിൽ സബ്സ്ട്രേറ്റുകൾക്ക് ഓക്സിഡേഷൻ സംഭവിക്കുമ്പോൾ ഊർജ്ജം സ്വതന്ത്രമാകുകയും കോശസ്തരങ്ങൾക്കിടയിൽ അയേൺ പമ്പുചെയ്യുകയും ഒരു ഇലക്ട്രൊകെമിക്കൽ ഗ്രേഡിയൻറ് സംജാതമാകുകയും ചെയ്യുന്നു. ബാക്ടീരിയയിലെ എസ്ക്ചേച്ചിയ കോള ബാക്ടീരിയയിൽ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ കൂടുതൽ വിശദമായി മനസ്സിലാക്കാം, ഇപ്പോൾ ആർക്കിയൽ സിസ്റ്റത്തിൽ വളരെക്കുറച്ചു മാത്രമേ മനസ്സിലാക്കാൻ കഴിഞ്ഞിട്ടുള്ളൂ.[64]
യൂകാരിയോട്ടിക്കുകളുടെയും പ്രോകാരിയോട്ടിക്കുകളുടെയും ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ തമ്മിലുള്ള പ്രധാന വ്യത്യാസം ബാക്ടീരിയയും ആർക്കിയയും ഇലക്ട്രോണുകൾ സംഭാവന ചെയ്യുന്നതോ സ്വീകരിക്കുന്നതോ ആയ പല പദാർത്ഥങ്ങളും ഉപയോഗിക്കുന്നു. വൈവിധ്യമാർന്ന പരിസ്ഥിതി വ്യവസ്ഥകൾക്കനുസരിച്ച് പ്രോകാരിയോട്ടിക്കുകളെ വളരാൻ ഇത് സഹായിക്കുന്നു.[65] ഉദാഹരണത്തിന്, ഇ. കോളിയിൽ, ഓക്സിഡൈസിങ് ഏജൻറുകളുടേയും റെഡൂസിങ് ഏജൻറുകളുടേയും ഒരു കൂട്ടം ജോഡികൾ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻറെ പ്രവർത്തനത്തിന് സഹായിക്കുന്നു. രാസപ്രവർത്തനത്തിലെ മിഡ്പോയിൻറിലെ പൊട്ടൻഷ്യൽ ഓക്സിഡൈസ് ചെയ്യുമ്പോഴോ റെഡൂസ് ചെയ്യുമ്പോഴോ എത്രത്തോളം ഊർജ്ജം പുറത്തുവരുന്നു എന്നതിനെ ആശ്രയിച്ചിരിക്കുന്നു. റെഡൂസിങ് ഏജൻറുകൾക്ക് നെഗറ്റീവ് പൊട്ടൻഷ്യലും ഓക്സിഡൈസിങ് ഏജൻറുകൾക്ക് പോസിറ്റീവ് പൊട്ടൻഷ്യലും ലഭിക്കുന്നു.
| ശ്വാസകോശ രാസാഗ്നികൾ | റെഡോക്സ് ജോഡി | Midpoint potential
(Volts) |
|---|---|---|
| ഫോർമേറ്റ് ഡിഹൈഡ്രോജിനേസ് | ബൈകാർബണേറ്റ് / ഫോർമേറ്റ് | −0.43 |
| ഡിഹൈഡ്രോജിനേസ് | പ്രോട്ടോൺ / ഹൈഡ്രജൻ | −0.42 |
| NADH ഡിഹൈഡ്രോജിനേസ് | NAD+ / NADH | −0.32 |
| Glycerol-3-phosphate ഡിഹൈഡ്രോജിനേസ് | DHAP / Gly-3-P | −0.19 |
| പൈറുവേറ്റ് ഓക്സിഡെയ്സ് | അസറ്റേറ്റ് + കാർബൺ ഡൈ ഓക്സൈഡ് / പൈറുവേറ്റ് | ? |
| ലാക്റ്റേറ്റ് ഡിഹൈഡ്രോജിനേസ് | പൈറുവേറ്റ് / ലാക്റ്റേറ്റ് | −0.19 |
| D-അമിനോ ആസിഡ് ഡിഹൈഡ്രോജിനേസ് | 2-ഓക്സൊസിഡ് + അമോണിയ / D-അമിനോ അമ്ലം | ? |
| ഗ്ലൂക്കോസ് ഡിഹൈഡ്രോജിനേസ് | ഗ്ലൂക്കോണേറ്റ് / ഗ്ലൂക്കോസ് | −0.14 |
| സക്സിനേറ്റ് ഡിഹൈഡ്രോജിനേസ് | ഫ്യൂമെറേറ്റ് / സക്സിനേറ്റ് | +0.03 |
| യൂബിക്വിനോൾ ഓക്സിഡേസ് | ഓക്സിജൻ / ജലം | +0.82 |
| നൈട്രേറ്റ് റിഡക്ടേസ് | നൈട്രേറ്റ് / നൈട്രൈറ്റ് | +0.42 |
| നൈട്രൈറ്റ് റിഡക്ടേസ് | നൈട്രൈറ്റ് / അമോണിയ | +0.36 |
| ഡൈമീഥൈൽ സൾഫോക്സൈഡ് റിഡക്ടേസ് | DMSO / DMS | +0.16 |
| ട്രൈമീഥൈലമൈൻ N-ഓക്സൈഡ് റിഡക്ടേസ് | TMAO / TMA | +0.13 |
| ഫ്യൂമെറേറ്റ് റിഡക്ടേസ് | ഫ്യൂമെറേറ്റ് / സക്സിനേറ്റ് | +0.03 |
മുകളിൽ കാണിച്ചിരിക്കുന്നതുപോലെ, റെഡൂസിങ് ഏജൻറുകളായ ഫോർമേറ്റ്, ഹൈഡ്രജൻ, അല്ലെങ്കിൽ ഇലക്ട്രോൺ ദാതാക്കളായ ലാക്റ്റേറ്റ്, സ്വീകർത്താക്കൾ ആയ നൈട്രേറ്റ്, ഡിഎംഎസ്ഒ, ഓക്സിജൻ എന്നിവയോടൊപ്പം ഇ. കോളിക്ക് വളരാൻ കഴിയുന്നു.[65] ഓക്സിഡൈസിങ് ഏജൻറിൻറെയും റെഡൂസിങ് ഏജൻറിൻറെയും ഇടയിലുള്ള മിഡ്പോയിൻറ് പൊട്ടൻഷ്യലിലെ വലിയ വ്യത്യാസം അവ പ്രവർത്തിക്കുമ്പോൾ കൂടുതൽ ഊർജ്ജം പുറത്തുവരുന്നു. ഈ സംയുക്തങ്ങളിൽ നിന്നും സക്സിനേറ്റ് / ഫ്യൂമെറേറ്റ് ജോഡി അസാധാരണമാണ്. അതിന്റെ മദ്ധ്യബിന്ദു പൊട്ടൻഷ്യൽ പൂജ്യത്തോട് വളരെ അടുത്താണ്. അതുകൊണ്ട് ഓക്സിജൻ പോലെയുള്ള ശക്തമായ ഓക്സിഡൈസിങ് ഏജന്റ് ലഭ്യമാണെങ്കിൽ സക്സിനേറ്റ് ഫ്യൂമെറേറ്റായി ഓക്സിഡൈസ് ചെയ്യപ്പെടുന്നു. അല്ലെങ്കിൽ ഫോർമേറ്റ് പോലുള്ള ശക്തമായ ഒരു റെഡൂസിങ് ഏജന്റ് ഉപയോഗിച്ച് ഫ്യൂമെറേറ്റ് റിഡക്ഷനു വിധേയമായി സക്സിനേറ്റ് ആകാൻ കഴിയുന്നു. ഈ ഇടവിട്ടുള്ള രാസപ്രവർത്തനത്തിന്റെ തീവ്രത വർദ്ധിപ്പിക്കുന്നതിനായി സക്സിനേറ്റ് ഡിഹൈഡ്രോജിനേസ്, ഫ്യൂമെറേറ്റ് റിഡക്ടേസ് എന്നീ എൻസൈമുകൾ ഉൾപ്രേരകമായി യഥാക്രമം പ്രവർത്തിക്കുന്നു.[67]
ചില പ്രോകാരിയോട്ട്സുകൾ റെഡോക്സ് ജോഡികൾ ഉപയോഗിക്കുന്നതിനാൽ അവയുടെ മിഡ്പോയിൻറ് പൊട്ടൻഷ്യലിൽ വളരെക്കുറച്ച് വ്യത്യാസം മാത്രമേ കാണപ്പെടുന്നുള്ളൂ. ഉദാഹരണത്തിന്, നൈട്രൊബാക്ടർ പോലുള്ള നൈട്രിഫൈയിംഗ് ബാക്ടീരിയകൾ നൈട്രൈറ്റ് ഓക്സിഡൈസിന് വിധേയമാക്കി നൈട്രേറ്റ് ആയിമാറുകയും ഓക്സിജന് ഇലക്ട്രോണുകളെ ദാനം ചെയ്യുകയും ചെയ്യുന്നു. പ്രോട്ടോണുകൾ പമ്പ് ചെയ്ത് ATP സൃഷ്ടിക്കാൻ ഈ രാസപ്രവർത്തനത്തിൽ പുറത്തുവിടുന്ന ചെറിയ അളവ് ഊർജ്ജം ധാരാളമാണ്. എന്നാൽ NADH അല്ലെങ്കിൽ NADPH ഉൽപ്പാദിപ്പിക്കുന്നതിന് ഉപചയത്തിൽ (അനാബോളിസം) നേരിട്ട് ഉപയോഗിക്കാൻ ഈ ഊർജ്ജം മതിയാകില്ല.[68] നൈട്രൈറ്റ് ഓക്സിഡോറിഡക്ടേസ് ഉപയോഗിച്ച് തിരിച്ചുള്ള ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയുടെ ഭാഗമായി പ്രോട്ടോൺ-പ്രേരണ ശക്തി ഉൽപാദിപ്പിക്കുന്നതിലൂടെ ഈ പ്രശ്നം പരിഹരിക്കപ്പെടുന്നു.[69][70]
ഏത് എൻസൈമുകൾ നിർമ്മിക്കപ്പെടുന്നുവോ, അതനുസരിച്ച് ഈ ഇലക്ട്രോൺ ദാതാക്കളുടേയും സ്വീകർത്താക്കളുടേയും ഉപയോഗം പരിസ്ഥിതി വ്യവസ്ഥകളനുസരിച്ച് പ്രോകാരിയോട്ട്സുകൾ നിയന്ത്രിക്കുന്നു.[71] വ്യത്യസ്തമായ ഓക്സിഡേസും റിഡക്ടേസും ഒരേ യൂബിക്വിനോൺ പൂൾ ഉപയോഗിക്കുന്നതിനാൽ ഈ സൌകര്യം സാധ്യമാണ്. ഇത് എൻസൈമിൻറെ പല സംയുക്തങ്ങളും ചേർന്നു പ്രവർത്തിക്കുകയും സാധാരണ യൂബിക്വിനോൾ ഇന്റർമീഡിയറ്റ് വഴി ബന്ധിപ്പിക്കുകയും ചെയ്യുന്നു.[66] ഈ ശ്വസനശൃംഖലയിൽ ഒരു മോഡുലാർ ഡിസൈൻ കാണപ്പെടുന്നതിനാൽ എൻസൈം സംവിധാനങ്ങളുടെ സെറ്റുകളെ എളുപ്പത്തിൽ പരസ്പരം മാറ്റാനും സാധിക്കുന്നു.
ഈ ഉപാപചയ വൈവിധ്യത്തിനു പുറമേ പ്രോകാരിയോട്ട്സുകളുടെ ഐസോസൈമുകൾക്ക് ഒരു പരിധി ഉണ്ട്. വിവിധ എൻസൈമുകൾ ഒരേ രാസപ്രവർത്തനത്തെ ത്വരിതപ്പെടുത്തുന്നു. ഉദാഹരണത്തിന്, ഇ. കോളിയിൽ ഓക്സിജൻ ഇലക്ട്രോൺ സ്വീകർത്താവായി ഉപയോഗിക്കുന്ന രണ്ട് വ്യത്യസ്ത തരം യൂബിക്വിനോൾ ഓക്സിഡേസ് കാണപ്പെടുന്നു. വളരെ ഉയർന്ന എയ്റോബിക് അവസ്ഥകളിൽ കോശം ഒരു ഓക്സിഡേസിനെ ഉപയോഗിക്കുകയും ഓക്സിജൻ താഴ്ന്ന അഫിനിറ്റി കാണിക്കുന്നതിനാൽ രണ്ട് പ്രോട്ടോണുകൾക്ക് ഒരു ഇലക്ട്രോൺ എന്ന അനുപാതത്തിൽ ഇലക്ട്രോണുകളെ കടത്തിവിടുകയും ചെയ്യുന്നു. എന്നിരുന്നാലും, ഓക്സിജന്റെ അളവ് കുറയുകയാണെങ്കിൽ ഒരു ഇലക്ട്രോണിന് ഒരു പ്രോട്ടോൺ മാത്രം കൈമാറ്റം ചെയ്യുന്ന വിധത്തിൽ ഓക്സിഡേസ് മാറുന്നു. എന്നാൽ ഓക്സിജനുമായി ഉയർന്ന അഫിനിറ്റി കാണിക്കുകയും ചെയ്യുന്നു.[72]
ATP സിന്തേസ് (സംയുക്തം V)
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: ATP സിന്തേസ്
ATP സിന്തേസ്, സംയുക്തം V എന്നും വിളിക്കുന്നു. ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ വഴിയിലെ അവസാന എൻസൈം ആണ് ഇത്. പ്രോകാരിയോട്ടുകളിലും, യൂകാരിയോട്ടുകളിലും ഈ എൻസൈം എല്ലാ തരത്തിലുള്ള ജീവിതരീതികളിലും പ്രവർത്തിക്കുന്നു.[73] എ.ഡി.പി, ഫോസ്ഫേറ്റ് (Pi) എന്നിവയിൽ നിന്ന് എ.ടി.പി യുടെ സിന്തസിസ് മുന്നോട്ട് കൊണ്ടുപോകുന്നതിന് കോശസ്തരങ്ങളിലൂടെ പ്രോട്ടോൺ ഗ്രേഡിയന്റിൽ ഊർജ്ജത്തെ സൂക്ഷിക്കാൻ എൻസൈം ഉപയോഗിക്കുന്നു. ATP സമന്വയിപ്പിക്കുന്നതിന് ആവശ്യമായ പ്രോട്ടോണുകളുടെ എണ്ണം മൂന്നോ നാലോ ആയി വ്യത്യാസപ്പെട്ടിരിക്കുന്നു.[74][75] ചില നിർദ്ദേശിക്കുന്ന കോശങ്ങൾക്ക് വ്യത്യസ്ത വ്യവസ്ഥകൾക്കനുസരിച്ച് ഈ അനുപാതം വ്യത്യാസപ്പെടാം.[76]
-
(6)
ഈ ഫോസ്ഫോറിലേഷൻ പ്രവർത്തനം ഒരു സംതുലിതാവസ്ഥയിലാണ് കാണപ്പെടുന്നത്. ഒന്നിടവിട്ടുള്ള പ്രോട്ടോൺ-പ്രേരണ ശക്തിയിൽ വ്യത്യാസം വരുത്തിക്കൊണ്ട് ഇതിനെ മാറ്റാം. ഒരു പ്രോട്ടോൺ-പ്രേരണശക്തിയുടെ അഭാവത്തിൽ ATP സിന്തേസിൻറെ പ്രവർത്തനം വലതു നിന്ന് ഇടത്തേക്കാണ് പ്രവർത്തിക്കുന്നത്. ATP ഹൈഡ്രോലൈസിങിന് വിധേയമാകുമ്പോൾ കോശസ്തരങ്ങൾക്കു കുറുകെ മാട്രിക്സിനുപുറത്ത് പ്രോട്ടോണുകളെ പമ്പ് ചെയ്യുന്നു. എന്നിരുന്നാലും, പ്രോട്ടോൺ-പ്രേരണ ശക്തി ഉയരുമ്പോൾ രാസപ്രവർത്തനം എതിർ ദിശയിൽ പ്രവർത്തിക്കാൻ നിർബന്ധിതമാകുന്നു. ഇത് ഇടതു നിന്ന് വലത്തേക്ക് തുടരുന്നു. അവയുടെ കോൺസെൻട്രേഷൻ ഗ്രേഡിയൻറ് താഴുകയും പ്രോട്ടോണുകൾ ഒഴുകാൻ അനുവദിക്കുകയും ചെയ്യുന്നു. എഡിപി എടിപിയിലേക്ക് മാറ്റപ്പെടുകയും ചെയ്യുന്നു.[73]വാക്യൂലാർ തരം H + -ATPases ഹൈഡ്രോളിസിസ് പ്രവർത്തനം വഴി സെല്ലുലാർ കംപാർട്ട്മെൻറുകളെ അമ്ളത്വമുള്ളതാക്കി മാറ്റുകയും പ്രോട്ടോണുകൾ പമ്പ് ചെയ്തുകൊണ്ട് ATP ഹൈഡ്രോളിസിസിന് വിധേയമാകുകയും ചെയ്യുന്നു.[77]
ATP സിന്തേസ്, കൂൺ പോലുള്ള രൂപത്തിലുള്ള വലിയ പ്രോട്ടീൻ സംയുക്തം ആണ്. സസ്തനികളിലെ എൻസൈം സംയുക്തങ്ങളിൽ 16 ഉപവിഭാഗങ്ങൾ കാണപ്പെടുന്നു. 600 കിലോഡാൾട്ടൻസ് ഭാരവും ഇതിനുണ്ട്.[73] സ്തരത്തിൽ ഉൾപ്പെട്ടിരിക്കുന്ന ഭാഗത്തെ എഫ്.ഒ എന്നാണ് വിളിക്കുന്നത്. ഇതിൽ കാർബൺ വലയങ്ങളുടെ സബ് ഉപവിഭാഗങ്ങളും പ്രോട്ടോൺ ചാനലും ഉൾപ്പെടുന്നു. തണ്ടിന്റെയും പന്ത് രൂപത്തിലുള്ള തലഭാഗത്തെ F1 എന്ന് വിളിക്കുന്നു, ഇത് എ ടി പി സ്ഥാനം ആണ്. F1 ഭാഗത്തിന്റെ അവസാനത്തിൽ പന്ത് ആകൃതിയിലുള്ള സംയുക്തത്തിൽ രണ്ട് വ്യത്യസ്ത തരത്തിലുള്ള ആറ് പ്രോട്ടീനുകൾ കാണപ്പെടുന്നു. (മൂന്ന് α ഉപയൂണീറ്റുകളും മൂന്ന് β ഉപയൂണീറ്റുകളും), അതേസമയം, "തണ്ടിൽ" ഒരു പ്രോട്ടീൻ ഉൾക്കൊള്ളുന്നു: γ ഉപയൂണീറ്റിനോടൊപ്പം തണ്ടിൻറെ അറ്റം α , β എന്നീ ഉപയൂണീറ്റുകളുള്ള പന്ത് ആകൃതിയിലുള്ള സംയുക്തം വരെ എത്തുന്നു.[78] α , β എന്നീ ഉപയൂണീറ്റുകൾ ന്യൂക്ലിയോടൈഡുകളുമായി ബന്ധിക്കുന്നു. എന്നാൽ β ഉപയൂണീറ്റ് മാത്രം ATP നിർമ്മാണത്തിലെ രാസപ്രവർത്തനത്തെ ത്വരിതപ്പെടുത്തുന്നു. നീണ്ട വടി പോലുള്ള β ഉപയൂണീറ്റ് F1 ഭാഗത്തിന്റെ വശങ്ങളിൽ എത്തിച്ചേരുകയും കോശസ്തരങ്ങളിലേയ്ക്ക് മടങ്ങുകയും α, β ഉപഘടകങ്ങൾ എൻസൈമിൻറെ അടിസ്ഥാനം ആയി മാറുകയും ചെയ്യുന്നു.
പ്രോട്ടോണുകൾ ചാനൽ വഴി കോശസ്തരങ്ങൾ കടന്നു പോകുമ്പോൾ ATP നിർമ്മാണത്തിൻറെ അടിസ്ഥാനത്തിൽ FO പ്രോട്ടോൺ മോട്ടോർ ഭ്രമണം ചെയ്യുന്നു.[79] അമിനോ ആസിഡുകളുടെ കാർബൺ വലയത്തിലെ ഉപഘടകങ്ങളിൽ അയോണൈസേഷനിൽ വരുന്ന മാറ്റങ്ങളിലൂടെ ഭ്രമണം ഉണ്ടാകാം. ഇലക്ട്രോസ്റ്റാറ്റിക് ഇടപെടലുകൾക്ക് ഇത് കാരണമാകുകയും കാർബൺ വലയത്തിലെ നിന്നുപോയ പ്രോട്ടീൻ ചാനലിനെ ചലിപ്പിക്കുകയും ചെയ്യുന്നു.[80] ഈ ഭ്രമണം ചെയ്യുന്ന റിങ് α, β ഉപയൂണീറ്റുകൾക്കുള്ളിലെ കേന്ദ്ര ആക്സിൽ (γ ഉപയുണിറ്റ് തണ്ടിൽ) ഭ്രമണം ചെയ്യുന്നു. α , β എന്നീ ഉപയൂണീറ്റുകൾ സൈഡ്-കൈപയോഗിച്ച് സ്വയം ഭ്രമണം ചെയ്യുന്നതിൽ നിന്നും തടയുകയും ഇത് ഒരു സ്റ്റാറ്ററായി പ്രവർത്തിക്കുകയും ചെയ്യുന്നു. α, β ഉപയൂണീറ്റിലെ പന്തിനകത്തെ γ ഉപയൂണീറ്റിലെ അറ്റത്തുള്ള ചലനം β ഉപയൂണീറ്റിലെ പ്രവർത്തനനിരതമായ ഭാഗങ്ങൾക്കുള്ള ഊർജ്ജം നൽകുന്നു. ചലനങ്ങളുടെ ചക്രം പൂർത്തിയാകുമ്പോൾ ATP നിർമ്മാണം നടക്കുകയും സ്വതന്ത്രമാകുകയും ചെയ്യുന്നു.[81]

ഈ ATP നിർമ്മാണ പ്രവർത്തനത്തെ ബൈൻഡിങ് ചെയിഞ്ച് മെക്കാനിസം എന്ന് വിളിക്കുന്നു.[82] "തുറന്ന" അവസ്ഥയിൽ, ADP, ഫോസ്ഫേറ്റ് എന്നിവ പ്രവർത്തനനിരതമായ ഭാഗത്തേക്ക് (ഡയഗ്രാമിൽ തവിട്ടുനിറത്തിൽ കാണിച്ചിരിക്കുന്നു). പ്രവേശിക്കുന്നു..പ്രോട്ടീൻ പിന്നെ തന്മാത്രകൾക്കു ചുറ്റും അടുത്തേയ്ക്കു വരുകയും അവയുമായി ബന്ധിക്കുകയും ചെയ്യുന്നു.(ചുവപ്പിൽ കാണിച്ചിരിക്കുന്നു). തുടർന്ന് എൻസൈം വീണ്ടും രൂപത്തിൽ മാറ്റം വരുത്തുകയും, ഈ തന്മാത്രകളെ ഒന്നിച്ചു ചേർക്കുകയും, തത്ഫലമായുണ്ടാകുന്ന പ്രവർത്തനനിരതമായ സ്ഥാനം "ദൃഢമായ" അവസ്ഥയ്ക്ക് കാരണമാകുകയും ചെയ്യുന്നു.(പിങ്ക് നിറത്തിൽ കാണിച്ചിരിക്കുന്നു). പുതുതായി നിർമ്മിച്ച വളരെ ഉയർന്ന അഫിനിറ്റിയുള്ള ATP തന്മാത്രകളുമായി ബന്ധനത്തിലേർപ്പെടുന്നു. അവസാനമായി, പ്രവർത്തനനിരതമായ സ്ഥാനത്തെ ചക്രങ്ങൾ തുറന്ന അവസ്ഥയിലേക്ക് മടങ്ങുന്നു. ATP സ്വതന്ത്രമാകുകയും കൂടുതൽ ATP, ഫോസ്ഫേറ്റ് എന്നിവയുമായി ബന്ധിച്ച് അടുത്ത ചക്രത്തിലേക്ക് പ്രവർത്തിക്കാൻ തയ്യാറെടുക്കുന്നു.
ചില ബാക്ടീരിയയിലും ആർക്കിയയിലും, ATP നിർമ്മാണം കോശസ്തരങ്ങളിലൂടെ പ്രോട്ടോണുകളുടെ ചലനത്തേക്കാൾ പകരം സോഡിയം അയോണുകളുടെ ചലനത്താൽ നയിക്കപ്പെടുന്നു.[83][84] മെത്തനോകോക്കസ് പോലെയുള്ള ആർക്കിയയിൽ കൂടുതൽ പ്രോട്ടീനുകൾ അടങ്ങിയ എൻസൈമിൻറെ ഒരു രൂപം ആയ A1Ao സിന്തേസ് അടങ്ങിയിരിക്കുന്നു. ബാക്ടീരിയ, യൂകാരിയോട്ടിക് എന്നിവയുടെ എ.ടി.പി സിന്തേസ് ഉപയൂണീറ്റുകളുമായി സീക്വൻസിൽ ചെറിയ സാമ്യം കാണപ്പെടുന്നു. ചില സ്പീഷീസുകളിൽ, എൻസൈമിലെ A1Ao രൂപത്തിൽ പ്രധാനമായും സോഡിയം ATP സിന്തേസിലേക്ക് നയിക്കുന്നത് സാധ്യമാണ്.[85] എന്നാൽ ഇത് എല്ലാ സാഹചര്യങ്ങളിലും ശരിയായിക്കൊള്ളണമെന്നില്ല.[84]
പ്രവർത്തനക്ഷമതയുള്ള ഓക്സിജൻ സ്പീഷീസ്
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: ഓക്സിഡേറ്റീവ് സ്ട്രെസ്സ് ആൻഡ് ആന്റിഓക്സിഡന്റ്
മോളിക്യുലർ ഓക്സിജൻ ശക്തമായ ഓക്സിഡൈസിങ് ഏജന്റ് ആയതിനാൽ ഉത്തമമായ ടെർമിനൽ ഇലക്ട്രോൺ സ്വീകർത്താവാണ്. ഓക്സിജൻറെ റിഡക്ഷൻ പ്രവർത്തനത്തിൽ തീർത്തും അപകടകരമായ ഇടനിലക്കാർ അതിൽ ഉൾപ്പെടുന്നു.[86] നാല് ഇലക്ട്രോണുകളും നാല് പ്രോട്ടോണുകളും കൈമാറ്റം ചെയ്യുമ്പോൾ റിഡക്ഷൻ സംഭവിക്കുകയും ഓക്സിജൻ ജലമായി മാറുന്നു. ഇത് അപകടകരമല്ല. ഒന്നോ രണ്ടോ ഇലക്ട്രോണുകൾ കൈമാറ്റം ചെയ്യുന്നതിലൂടെ ഇത് സൂപ്പർ ഓക്സൈഡ് അല്ലെങ്കിൽ പെറോക്സൈഡ് ആയോണുകൾ ഉണ്ടാക്കുന്നു. ഇവ പ്രവർത്തനപരമായി അപകടകാരിയാണ്.
-
(7)
ഈ പ്രവർത്തനനിരതമായ ഓക്സിജൻ സ്പീഷീസുകളും അവയുടെ ഹൈഡ്രോക്സിൽ റാഡിക്കൽ പോലുള്ള പ്രവർത്തന ഉൽപന്നങ്ങളും, കോശങ്ങൾക്ക് വളരെ ദോഷകരമാണ്, അവ പ്രോട്ടീനുകൾ ഓക്സീകരിക്കുകയും ഡിഎൻഎയിൽ മ്യൂട്ടേഷനുകൾക്ക് കാരണമാക്കുകയും ചെയ്യുന്നു. ഈ സെല്ലുലാർ തകരാറുകൾ രോഗത്തിന് കാരണമാവുകയും, വാർധക്യത്തിന്റെ ഒരു കാരണമായി തീരുകയും ചെയ്യുന്നു.[87][88]
സൈറ്റോക്രോം സി ഓക്സിഡേസ് സംയുക്തം ഓക്സിജൻ റിഡക്ഷന് വിധേയമായി ജലമാക്കി മാറ്റാൻ വളരെ ഫലപ്രദമാണ്. ഇതിൻറെ വളരെക്കുറച്ചു മാത്രം സ്വതന്ത്രമാകുകയും എന്നാൽ ചെറിയ അളവിലുള്ള സൂപ്പർ ഓക്സൈഡ് ആനയോണും പെറോക്സൈഡും ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖല സൃഷ്ടിക്കുന്നു.[89] സംയുക്തം III ലെ കോഎൻസൈം Q വിൻറെ റിഡക്ഷൻ വളരെ പ്രധാനമാണ്. Q ചക്രത്തിലെ ഇൻറർമീഡിയേറ്റ് ആയി ഫ്രീ റാഡിക്കലുള്ള യൂബിസെമിക്വിനോൺ രൂപംകൊള്ളുന്നു. സ്ഥിരതയില്ലാത്ത ഈ സ്പീഷീസുകൾ ഇലക്ട്രോൺ ചോർച്ചയ്ക്ക് കാരണമാകുന്നു. ഇലക്ട്രോണുകൾ നേരിട്ട് ഓക്സിജന് കൈമാറ്റം ചെയ്യുമ്പോൾ സൂപ്പർ ഓക്സൈഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു[90].പ്രോട്ടോൺ-പമ്പിംഗ് സംയുക്തങ്ങളിൽ സജീവമായ ഓക്സിജൻ ഇനങ്ങൾ ഉത്പാദിപ്പിക്കപ്പെടുന്നതിനാൽ, ഉയർന്ന കോശസ്തര പൊട്ടൻഷ്യൽ കാണപ്പെടുന്നു. കോശസ്തര പൊട്ടൻഷ്യൽ നിലനിർത്താൻ മൈറ്റോകോൺട്രിയയുടെ പ്രവർത്തനങ്ങളെ ക്രമപ്പെടുത്താൻ ഒരു ഇടുങ്ങിയ പരിധിയിലൂടെ ഓക്സിഡൻറ് ഉത്പാദനത്തിലൂടെ ATP നിർമ്മാണം സമതുലിതാവസ്ഥയിലെത്തിക്കുന്നു.[91] ഉദാഹരണത്തിന്, ഓക്സിഡൻറുകൾക്ക് ജോഡികളാകാത്ത പ്രോട്ടീനുകളുമായി പ്രവർത്തിച്ച് കോശസ്തര പൊട്ടൻഷ്യൽ കുറയ്ക്കുന്നു.[92]
ഈ പ്രവർത്തനനിരതമായ ഓക്സിജൻ സ്പീഷീസുകളെ പ്രതിരോധിക്കാൻ കോശങ്ങളിൽ ധാരാളം ആന്റിഓക്സിഡന്റ് സംവിധാനങ്ങളിൽ ആൻറിഓക്സിഡന്റ് വിറ്റാമിൻനുകളായ വിറ്റാമിൻ സി, വിറ്റാമിൻ ഇ, തുടങ്ങിയവയും ആൻറിഓക്സിഡന്റ് എൻസൈമുകളായ സൂപ്പർ ഓക്സൈഡ് ഡിസ്മ്യൂട്ടേസ്, കാറ്റലേസ്, പെറോക്സിഡേസ് എന്നിവയും അടങ്ങിയിരിക്കുന്നു.[93] ഇത് പ്രവർത്തനനിരതമായ സ്പീഷീസുകളെ നിർവീര്യമാക്കുകയും കോശങ്ങളുടെ നാശം കുറയ്ക്കുകയും ചെയ്യുന്നു.
ഇൻഹിബിറ്റേഴ്സ്
[തിരുത്തുക]ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ തടയുന്ന നിരവധി അറിയപ്പെടുന്ന മരുന്നുകളും ടോക്സിനുകളും ഉണ്ട്. എന്നിരുന്നാലും ഈ ടോക്സിനുകളിൽ ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയെ തടയുന്ന ഒരു എൻസൈം മാത്രമേയുള്ളൂ. ഈ പ്രക്രിയയിൽ ഏതെങ്കിലും ഘട്ടത്തിൽ തടസ്സപ്പെടുത്തുന്നത് പ്രക്രിയയുടെ ബാക്കിയുള്ളതിനെ തടയുന്നു. ഉദാഹരണത്തിന്, ഒലിഗോമൈസിൻ ATP സിന്തേസിനെ തടഞ്ഞാൽ പ്രോട്ടോണുകൾക്ക് മൈറ്റോകോൺട്രിയോണിലൂടെ തിരിച്ച് സഞ്ചരിക്കാൻ കഴിയില്ല.[94] അതിനെ തരണം ചെയ്യുന്നതിനായി ഗ്രേഡിയൻറ് കൂടുതൽ ശക്തമായി തീരുകയും തത്ഫലമായി, പ്രോട്ടോൺ പമ്പിംഗ് തടസ്സപ്പെടുന്നു. NADH- ൽ കൂടുതൽ ഓക്സീസൈഡ് ചെയ്യപ്പെടാത്തതിനാൽ സിഡ്രിക് ആസിഡ് സൈക്കിൾ പ്രവർത്തനം തടസ്സപ്പെടുകയും ചെയ്യുന്നതു കാരണം എൻ.എ.ഡി + ന്റെ സാന്ദ്രത ഈ എൻസൈമുകൾ ഉപയോഗിക്കാൻ കഴിയുന്ന സാന്ദ്രതയ്ക്ക് താഴെയാണ്.
| Compounds | Use | Site of action | ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ പ്രഭാവം |
|---|---|---|---|
| സയനൈഡ് കാർബൺ മോണോക്സൈഡ് Azide ഹൈഡ്രജൻ സൾഫൈഡ് |
വിഷം | സംയുക്തം IV | ഇലക്ട്രോൺ ട്രാൻസ്പോർട്ട് ശൃംഖലയിൽ അയേണിൻറെയും കോപ്പറിൻറെയും മധ്യത്തിൽ സൈറ്റോക്രോം സി ഓക്സിഡേസ് ഓക്സിജനേക്കാൾ വലിയ ബലത്തിൽ ബന്ധിക്കുന്നതിനാൽ ഓക്സിജൻറെ റിഡക്ഷനെ തടയുന്നു.[95] |
| ഒലിഗോമൈസിൻ | ആൻറിബയോട്ടിക് | സംയുക്തം V | Inhibits ATP synthase by blocking the flow of protons through the Fo subunit.[94] |
| CCCP 2,4-ഡൈനൈട്രോഫിനോൾ |
വിഷം, ഭാരം-നഷ്ടം[N 1] | ആന്തരികകോശസ്തരങ്ങൾ | Ionophores that disrupt the proton gradient by carrying protons across a membrane. This ionophore uncouples proton pumping from ATP synthesis because it carries protons across the inner mitochondrial membrane.[96] |
| റോട്ടെനോൺ | കീടനാശിനി | സംയുക്തം I | Prevents the transfer of electrons from complex I to ubiquinone by blocking the ubiquinone-binding site.[97] |
| മാലൊനേറ്റ്, ഓക്സാലോഅസെറ്റേറ്റ് | വിഷം | സംയുക്തം II | കോംപെറ്റേറ്റീവ് ഇൻഹിബിറ്റേഴ്സ് സക്സിനേറ്റ് ഡിഹൈഡ്രോജിനേസ് (സംയുക്തം II).[98] |
| ആന്റിമൈസിൻ A | പിസ്കിസൈഡ് | സംയുക്തം III | Binds to the Qi site of cytochrome c reductase, thereby inhibiting the യൂബിക്വിനോൾ.ഓക്സീകരണം |
ഓക്സീഡേറ്റീവ് ഫോസ്ഫോറിലേഷനിലെ എല്ലാ ഇൻഹിബിറ്ററുകളും വിഷ പദാർത്ഥങ്ങളാണ്. ബ്രൗൺ അഡിപ്പോസ് ടിഷ്യൂവിൽ, ക്രമീകരിക്കപ്പെട്ട പ്രോട്ടോൺ ചാനലുകളെ അൺകപ്ലിങ് പ്രോട്ടീൻസ് എന്നുവിളിക്കുന്നു. ഇത് ATP നിർമ്മാണത്തിൽ നിന്ന് ശ്വസനത്തെ വേർപെടുത്തുന്നു.[99] ഈ ദ്രുതഗതിയിലുള്ള ശ്വസനം ചൂട് ഉളവാക്കുന്നു, പ്രത്യേകിച്ച് മൃഗങ്ങളുടെ സന്തുലിതാവസ്ഥ നിലനിർത്താൻ സമ്മർദ്ദം നേരിടുന്ന കോശങ്ങളിലെ പ്രോട്ടീനുകളിൽ കൂടുതൽ രാസപ്രവർത്തനം നടക്കുന്നു.[100]
ചരിത്രം
[തിരുത്തുക]കൂടുതൽ വിവരങ്ങൾ: ജൈവരസതന്ത്രം, ഹിസ്റ്ററി ഓഫ് മോളികുലർ ബയോളജി
1906- ൽ ആർതർ ഹാർഡൻറെ റിപ്പോർട്ട് പ്രകാരം ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷനിൽ സെല്ലുലാർ ഫെർമെന്റേഷനിൽ ഫോസ്ഫേറ്റിന്റെ പ്രധാന പങ്ക് എന്ന പഠനമണ്ഡലം ആരംഭിച്ചു. തുടക്കത്തിൽ പഞ്ചസാര ഫോസ്ഫേറ്റ് മാത്രമേ ഉൾപ്പെട്ടിരുന്നുള്ളൂ.[101] എന്നിരുന്നാലും, 1940 കളുടെ ആരംഭത്തിൽ, പഞ്ചസാരയുടെ ഓക്സിഡേഷനും ATP യുടെ തലമുറയും തമ്മിലുള്ള സ്ഥിരമായ ബന്ധം ഹെർമൻ കാൽക്കർ സ്ഥാപിച്ചു.[102] 1941-ൽ ഫ്രിറ്റ്സ് ആൽബർട്ട് ലിപ്മാൻ പുറത്തിറക്കിയ ഊർജ്ജ കൈമാറ്റത്തിൽ എ.ടി.പി.യുടെ മുഖ്യ പങ്ക് തെളിയിക്കുന്നു.[103] പിന്നീട് 1949-ൽ മോറിസ് ഫ്രീഡ്കിനും ആൽബർട്ട് എൽ. ലേഹിനിംഗും കോഎൻസൈം NADH സിട്രിക് ആസിഡ് സൈക്കിൾ, എ.ടി.പി സിന്തസിസ് തുടങ്ങിയ ഉപാപചയ പാതകളുമായി കണ്ണിചേർക്കപ്പെട്ടിരിക്കുന്നതായി തെളിയിച്ചു.[104] 1939-ൽ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷൻ എന്ന പദം വൊളാഡിമിർ ബെലിറ്റ്സർ (UK) ഉപയോഗിക്കാൻ തുടങ്ങി.[105][106]
മറ്റൊരു ഇരുപത് വർഷക്കാലം, ATP സൃഷ്ടിക്കുന്നതിനുള്ള സംവിധാനം അജ്ഞാതമായിരുന്നു, ശാസ്ത്രീയർ ഓക്സിഡേഷനും ഫോസ്ഫോറിലേഷനും കണ്ണിചേർക്കപ്പെടുന്ന "ഉയർന്ന ഊർജ്ജമുള്ള ഒരു ഇന്റർമീഡിയറ്റ്" തിരഞ്ഞു[107] 1961 ൽ കെമിഓസ്മോട്ടിക് സിദ്ധാന്തത്തിൻറെ പ്രസിദ്ധീകരണത്തോടെ പീറ്റേർ ഡി മിച്ചൽ ഈ പ്രശ്നം പരിഹരിച്ചു.[108] ആദ്യം ഈ നിർദ്ദേശം വളരെ വിവാദപരമായിരുന്നു, പക്ഷെ അത് സാവകാശം സ്വീകരിക്കാൻ തുടങ്ങി. 1978-ൽ മിഷേലിന് നൊബേൽ പുരസ്കാരം ലഭിക്കുകയുണ്ടായി.[109][110] ഇലക്ട്രോൺ-ട്രാൻസ്പോർട്ട് ശൃംഖലയിലെ സംയുക്തങ്ങളെ ഡേവിഡ് ഇ. ഗ്രീനും ATP സിന്തസെസിൽ എഫ്രയിം റാക്കറും തുടർന്നുള്ള ഗവേഷണങ്ങളിൽ എൻസൈമുകൾ ശുദ്ധീകരിക്കാനും എൻസൈമുകളുടെ സ്വഭാവം മനസ്സിലാക്കാനും ശ്രദ്ധകേന്ദ്രീകരിച്ചു.[111] ATP സിന്തെസിസ് മെക്കാനിസത്തിലെ നിർണ്ണായകമായ ഘട്ടത്തിലെ പ്രശ്നം പരിഹരിക്കാനുള്ള ശ്രമത്തിൽ 1973 ൽ പോൾ ഡി. ബോയർ, "ബൈൻഡിംഗ് ചെയിഞ്ച്" മെക്കാനിസം വികസിപ്പിക്കുന്നതിലേയ്ക്ക് വഴിതെളിയിച്ചു. 1982-ലെ അദ്ദേഹത്തിന്റെ റൊട്ടേഷണൽ കാറ്റലിസ്റ്റിൻറെ റാഡിക്കൽ നിർദ്ദേശം ഇതിനെ പിൻതുടർന്നു.[112][113] ജോൺ ഇ വാക്കർ ഓക്സിഡേറ്റീവ് ഫോസ്ഫോറിലേഷനിൽ ഉൾപ്പെടുന്ന എൻസൈമുകളിൽ ഘടനാപരമായ പഠനങ്ങൾ നടത്തിയിട്ടുണ്ട്. വാക്കർ, ബോയർ എന്നിവർക്ക് 1997-ൽ ഇതിന് നോബൽ സമ്മാനം ലഭിക്കുകയുണ്ടായി.[114]
ഇതും കാണുക
[തിരുത്തുക]അവലംബം
[തിരുത്തുക]- ↑ "oxidative Meaning in the Cambridge English Dictionary". dictionary.cambridge.org. Archived from the original on 24 January 2018. Retrieved 28 April 2018.
- ↑ Budavari, Susan, ed. (2001), The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th ed.), Merck, ISBN 0911910131
- ↑ "mitochondria". Online Etymology Dictionary.
- ↑ "aerobe" at Dorland's Medical Dictionary
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002-01-01). "Electron-Transport Chains and Their Proton Pumps".
- ↑ Cox, Michael; Nelson, David R.; Lehninger, Albert L (2008). Lehninger principles of biochemistry. San Francisco: W.H. Freeman. ഐ.എസ്.ബി.എൻ. 0-7167-7108-X.
- ↑ Mitchell P, Moyle J (1967). "Chemiosmotic hypothesis of oxidative phosphorylation". Nature. 213 (5072): 137–9. Bibcode:1967Natur.213..137M. doi:10.1038/213137a0. PMID 4291593.
- ↑ 8.0 8.1 Dimroth P, Kaim G, Matthey U (1 January 2000). "Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases". J. Exp. Biol. 203 (Pt 1): 51–9. PMID 10600673. Archived from the original on 30 September 2007.
- ↑ Schultz BE, Chan SI (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23–65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051.
- ↑ Rich PR (2003). "The molecular machinery of Keilin's respiratory chain". Biochem. Soc. Trans. 31 (Pt 6): 1095–105. doi:10.1042/bst0311095. PMID 14641005.
- ↑ Porter RK, Brand MD (1995). "Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes". Biochem. J. 310 (Pt 2): 379–82. doi:10.1042/bj3100379. PMC 1135905. PMID 7654171.
- ↑ Mathews FS (1985). "The structure, function and evolution of cytochromes". Prog. Biophys. Mol. Biol. 45 (1): 1–56. doi:10.1016/0079-6107(85)90004-5. PMID 3881803.
- ↑ Wood PM (1983). "Why do c-type cytochromes exist?". FEBS Lett. 164 (2): 223–6. doi:10.1016/0014-5793(83)80289-0. PMID 6317447.
- ↑ Crane FL (1 December 2001). "Biochemical functions of coenzyme Q10". J Am Coll Nutr. 20 (6): 591–8. doi:10.1080/07315724.2001.10719063. PMID 11771674.
- ↑ Mitchell P (1979). "Keilin's respiratory chain concept and its chemiosmotic consequences". Science. 206 (4423): 1148–59. Bibcode:1979Sci...206.1148M. doi:10.1126/science.388618. PMID 388618.
- ↑ Søballe B, Poole RK (1999). "Microbial ubiquinones: multiple roles in respiration, gene regulation and oxidative stress management" (PDF). Microbiology. 145 (8): 1817–30. doi:10.1099/13500872-145-8-1817. PMID 10463148. Archived (PDF) from the original on 2008-05-29.
- ↑ 17.0 17.1 Schultz BE, Chan SI (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23–65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051.
- ↑ Johnson DC, Dean DR, Smith AD, Johnson MK (2005). "Structure, function, and formation of biological iron-sulfur clusters". Annu. Rev. Biochem. 74: 247–81. doi:10.1146/annurev.biochem.74.082803.133518. PMID 15952888.
- ↑ Page CC, Moser CC, Chen X, Dutton PL (1999). "Natural engineering principles of electron tunnelling in biological oxidation-reduction". Nature. 402 (6757): 47–52. Bibcode:1999Natur.402...47P. doi:10.1038/46972. PMID 10573417.
- ↑ Leys D, Scrutton NS (2004). "Electrical circuitry in biology: emerging principles from protein structure". Curr. Opin. Struct. Biol. 14 (6): 642–7. doi:10.1016/j.sbi.2004.10.002. PMID 15582386.
- ↑ Boxma B, de Graaf RM, van der Staay GW, van Alen TA, Ricard G, Gabaldón T, van Hoek AH, Moon-van der Staay SY, Koopman WJ, van Hellemond JJ, Tielens AG, Friedrich T, Veenhuis M, Huynen MA, Hackstein JH (2005). "An anaerobic mitochondrion that produces hydrogen". Nature. 434 (7029): 74–9. Bibcode:2005Natur.434...74B. doi:10.1038/nature03343. PMID 15744302.
- ↑ 22.0 22.1 22.2 22.3 22.4 22.5 22.6 22.7 Medical CHEMISTRY Compendium. By Anders Overgaard Pedersen and Henning Nielsen. Aarhus University. 2008
- ↑ 23.0 23.1 Hirst J (2005). "Energy transduction by respiratory complex I--an evaluation of current knowledge" (PDF). Biochem. Soc. Trans. 33 (Pt 3): 525–9. doi:10.1042/BST0330525. PMID 15916556.
- ↑ Lenaz G, Fato R, Genova ML, Bergamini C, Bianchi C, Biondi A (2006). "Mitochondrial Complex I: structural and functional aspects". Biochim. Biophys. Acta. 1757 (9–10): 1406–20. doi:10.1016/j.bbabio.2006.05.007. PMID 16828051.
- ↑ 25.0 25.1 Sazanov LA, Hinchliffe P (2006). "Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus". Science. 311 (5766): 1430–6. Bibcode:2006Sci...311.1430S. doi:10.1126/science.1123809. PMID 16469879.
- ↑ Efremov R.G., Baradaran R., & Sazanov L.A., (2010) The arcdhitecture of respiratory complex I, Nature 465, 441-445
- ↑ Baranova EA, Holt PJ, Sazanov LA (2007). "Projection structure of the membrane domain of Escherichia coli respiratory complex I at 8 A resolution". J. Mol. Biol. 366 (1): 140–54. doi:10.1016/j.jmb.2006.11.026. PMID 17157874.
- ↑ Friedrich T, Böttcher B (2004). "The gross structure of the respiratory complex I: a Lego System". Biochim. Biophys. Acta. 1608 (1): 1–9. doi:10.1016/j.bbabio.2003.10.002. PMID 14741580.
- ↑ Hirst J (January 2010). "Towards the molecular mechanism of respiratory complex I". Biochem. J. 425 (2): 327–39. doi:10.1042/BJ20091382. PMID 20025615.
- ↑ Cecchini G (2003). "Function and structure of complex II of the respiratory chain". Annu. Rev. Biochem. 72: 77–109. doi:10.1146/annurev.biochem.72.121801.161700. PMID 14527321.
- ↑ Yankovskaya V, Horsefield R, Törnroth S, Luna-Chavez C, Miyoshi H, Léger C, Byrne B, Cecchini G, Iwata S, et al. (2003). "Architecture of succinate dehydrogenase and reactive oxygen species generation". Science. 299 (5607): 700–4. Bibcode:2003Sci...299..700Y. doi:10.1126/science.1079605. PMID 12560550.
- ↑ Horsefield R, Iwata S, Byrne B (2004). "Complex II from a structural perspective". Curr. Protein Pept. Sci. 5 (2): 107–18. doi:10.2174/1389203043486847. PMID 15078221.
- ↑ Kita K, Hirawake H, Miyadera H, Amino H, Takeo S (2002). "Role of complex II in anaerobic respiration of the parasite mitochondria from Ascaris suum and Plasmodium falciparum". Biochim. Biophys. Acta. 1553 (1–2): 123–39. doi:10.1016/S0005-2728(01)00237-7. PMID 11803022.
- ↑ Painter HJ, Morrisey JM, Mather MW, Vaidya AB (2007). "Specific role of mitochondrial electron transport in blood-stage Plasmodium falciparum". Nature. 446 (7131): 88–91. Bibcode:2007Natur.446...88P. doi:10.1038/nature05572. PMID 17330044.
- ↑ Ramsay RR, Steenkamp DJ, Husain M (1987). "Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase". Biochem. J. 241 (3): 883–92. doi:10.1042/bj2410883. PMC 1147643. PMID 3593226.
- ↑ Zhang J, Frerman FE, Kim JJ (2006). "Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool". Proc. Natl. Acad. Sci. U.S.A. 103 (44): 16212–7. Bibcode:2006PNAS..10316212Z. doi:10.1073/pnas.0604567103. PMC 1637562. PMID 17050691.
- ↑ Ikeda Y, Dabrowski C, Tanaka K (25 January 1983). "Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase". J. Biol. Chem. 258 (2): 1066–76. PMID 6401712. Archived from the original on 29 September 2007.
- ↑ Ruzicka FJ, Beinert H (1977). "A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway" (PDF). J. Biol. Chem. 252 (23): 8440–5. PMID 925004. Archived (PDF) from the original on 2007-09-27.
- ↑ Ishizaki K, Larson TR, Schauer N, Fernie AR, Graham IA, Leaver CJ (2005). "The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation". Plant Cell. 17 (9): 2587–600. doi:10.1105/tpc.105.035162. PMC 1197437. PMID 16055629.
- ↑ Berry EA, Guergova-Kuras M, Huang LS, Crofts AR (2000). "Structure and function of cytochrome bc complexes" (PDF). Annu. Rev. Biochem. 69: 1005–75. doi:10.1146/annurev.biochem.69.1.1005. PMID 10966481. Archived (PDF) from the original on 2015-12-28.
- ↑ Crofts AR (2004). "The cytochrome bc1 complex: function in the context of structure". Annu. Rev. Physiol. 66: 689–733. doi:10.1146/annurev.physiol.66.032102.150251. PMID 14977419.
- ↑ Iwata S, Lee JW, Okada K, Lee JK, Iwata M, Rasmussen B, Link TA, Ramaswamy S, Jap BK (1998). "Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex". Science. 281 (5373): 64–71. Bibcode:1998Sci...281...64I. doi:10.1126/science.281.5373.64. PMID 9651245.
- ↑ Trumpower BL (1990). "The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex" (PDF). J. Biol. Chem. 265 (20): 11409–12. PMID 2164001. Archived (PDF) from the original on 2007-09-27.
- ↑ Hunte C, Palsdottir H, Trumpower BL (2003). "Protonmotive pathways and mechanisms in the cytochrome bc1 complex". FEBS Lett. 545 (1): 39–46. doi:10.1016/S0014-5793(03)00391-0. PMID 12788490.
- ↑ Calhoun MW, Thomas JW, Gennis RB (1994). "The cytochrome oxidase superfamily of redox-driven proton pumps". Trends Biochem. Sci. 19 (8): 325–30. doi:10.1016/0968-0004(94)90071-X. PMID 7940677.
- ↑ Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S (1996). "The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A". Science. 272 (5265): 1136–44. Bibcode:1996Sci...272.1136T. doi:10.1126/science.272.5265.1136. PMID 8638158.
- ↑ Yoshikawa S, Muramoto K, Shinzawa-Itoh K, Aoyama H, Tsukihara T, Shimokata K, Katayama Y, Shimada H (2006). "Proton pumping mechanism of bovine heart cytochrome c oxidase". Biochim. Biophys. Acta. 1757 (9–10): 1110–6. doi:10.1016/j.bbabio.2006.06.004. PMID 16904626.
- ↑ Rasmusson AG, Soole KL, Elthon TE (2004). "Alternative NAD(P)H dehydrogenases of plant mitochondria". Annu Rev Plant Biol. 55: 23–39. doi:10.1146/annurev.arplant.55.031903.141720. PMID 15725055.
- ↑ Menz RI, Day DA (1996). "Purification and characterization of a 43-kDa rotenone-insensitive NADH dehydrogenase from plant mitochondria". J. Biol. Chem. 271 (38): 23117–20. doi:10.1074/jbc.271.38.23117. PMID 8798503. Archived from the original on 2007-09-29.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ McDonald A, Vanlerberghe G (2004). "Branched mitochondrial electron transport in the Animalia: presence of alternative oxidase in several animal phyla". IUBMB Life. 56 (6): 333–41. doi:10.1080/1521-6540400000876. PMID 15370881.
- ↑ Sluse FE, Jarmuszkiewicz W (1998). "Alternative oxidase in the branched mitochondrial respiratory network: an overview on structure, function, regulation, and role". Braz. J. Med. Biol. Res. 31 (6): 733–47. doi:10.1590/S0100-879X1998000600003. PMID 9698817.
- ↑ Moore AL, Siedow JN (1991). "The regulation and nature of the cyanide-resistant alternative oxidase of plant mitochondria". Biochim. Biophys. Acta. 1059 (2): 121–40. doi:10.1016/S0005-2728(05)80197-5. PMID 1883834.
- ↑ Vanlerberghe GC, McIntosh L (1997). "ALTERNATIVE OXIDASE: From Gene to Function". Annu. Rev. Plant Physiol. Plant Mol. Biol. 48: 703–734. doi:10.1146/annurev.arplant.48.1.703. PMID 15012279.
- ↑ Ito Y, Saisho D, Nakazono M, Tsutsumi N, Hirai A (1997). "Transcript levels of tandem-arranged alternative oxidase genes in rice are increased by low temperature". Gene. 203 (2): 121–9. doi:10.1016/S0378-1119(97)00502-7. PMID 9426242.
- ↑ Maxwell DP, Wang Y, McIntosh L (1999). "The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells". Proc. Natl. Acad. Sci. U.S.A. 96 (14): 8271–6. Bibcode:1999PNAS...96.8271M. doi:10.1073/pnas.96.14.8271. PMC 22224. PMID 10393984. Archived from the original on 2007-05-16.
- ↑ Lenaz G (2001). "A critical appraisal of the mitochondrial coenzyme Q pool". FEBS Lett. 509 (2): 151–5. doi:10.1016/S0014-5793(01)03172-6. PMID 11741580.
- ↑ Heinemeyer J, Braun HP, Boekema EJ, Kouril R (2007). "A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria" (PDF). J. Biol. Chem. 282 (16): 12240–8. doi:10.1074/jbc.M610545200. PMID 17322303. Archived (PDF) from the original on 2018-04-28.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ Schägger H, Pfeiffer K (2000). "Supercomplexes in the respiratory chains of yeast and mammalian mitochondria". EMBO J. 19 (8): 1777–83. doi:10.1093/emboj/19.8.1777. PMC 302020. PMID 10775262.
- ↑ Schägger H (2002). "Respiratory chain supercomplexes of mitochondria and bacteria". Biochim. Biophys. Acta. 1555 (1–3): 154–9. doi:10.1016/S0005-2728(02)00271-2. PMID 12206908.
- ↑ Schägger H, Pfeiffer K (2001). "The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes". J. Biol. Chem. 276 (41): 37861–7. doi:10.1074/jbc.M106474200. PMID 11483615. Archived from the original on 2007-09-29.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ Lenaz G, Fato R, Genova ML, Bergamini C, Bianchi C, Biondi A (2006). "Mitochondrial Complex I: structural and functional aspects". Biochim. Biophys. Acta. 1757 (9–10): 1406–20. doi:10.1016/j.bbabio.2006.05.007. PMID 16828051.
- ↑ Gupte S, Wu ES, Hoechli L, Hoechli M, Jacobson K, Sowers AE, Hackenbrock CR (1984). "Relationship between lateral diffusion, collision frequency, and electron transfer of mitochondrial inner membrane oxidation-reduction components". Proc. Natl. Acad. Sci. U.S.A. 81 (9): 2606–10. Bibcode:1984PNAS...81.2606G. doi:10.1073/pnas.81.9.2606. PMC 345118. PMID 6326133.
- ↑ Nealson KH (1999). "Post-Viking microbiology: new approaches, new data, new insights". Orig Life Evol Biosph. 29 (1): 73–93. doi:10.1023/A:1006515817767. PMID 11536899.
- ↑ Schäfer G, Engelhard M, Müller V (1999). "Bioenergetics of the Archaea". Microbiol. Mol. Biol. Rev. 63 (3): 570–620. PMC 103747. PMID 10477309.
- ↑ 65.0 65.1 Ingledew WJ, Poole RK (1984). "The respiratory chains of Escherichia coli". Microbiol. Rev. 48 (3): 222–71. PMC 373010. PMID 6387427.
- ↑ 66.0 66.1 Unden G, Bongaerts J (1997). "Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors". Biochim. Biophys. Acta. 1320 (3): 217–34. doi:10.1016/S0005-2728(97)00034-0. PMID 9230919.
- ↑ Cecchini G, Schröder I, Gunsalus RP, Maklashina E (2002). "Succinate dehydrogenase and fumarate reductase from Escherichia coli". Biochim. Biophys. Acta. 1553 (1–2): 140–57. doi:10.1016/S0005-2728(01)00238-9. PMID 11803023.
- ↑ Freitag A, Bock E; Bock (1990). "Energy conservation in Nitrobacter". FEMS Microbiology Letters. 66 (1–3): 157–62. doi:10.1111/j.1574-6968.1990.tb03989.x.
- ↑ Starkenburg SR, Chain PS, Sayavedra-Soto LA, Hauser L, Land ML, Larimer FW, Malfatti SA, Klotz MG, Bottomley PJ, Arp DJ, Hickey WJ (2006). "Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255". Appl. Environ. Microbiol. 72 (3): 2050–63. doi:10.1128/AEM.72.3.2050-2063.2006. PMC 1393235. PMID 16517654. Archived from the original on 2007-10-13.
- ↑ Yamanaka T, Fukumori Y (1988). "The nitrite oxidizing system of Nitrobacter winogradskyi". FEMS Microbiol. Rev. 4 (4): 259–70. doi:10.1111/j.1574-6968.1988.tb02746.x. PMID 2856189.
- ↑ Iuchi S, Lin EC (1993). "Adaptation of Escherichia coli to redox environments by gene expression". Mol. Microbiol. 9 (1): 9–15. doi:10.1111/j.1365-2958.1993.tb01664.x. PMID 8412675.
- ↑ Calhoun MW, Oden KL, Gennis RB, de Mattos MJ, Neijssel OM (1993). "Energetic efficiency of Escherichia coli: effects of mutations in components of the aerobic respiratory chain" (PDF). J. Bacteriol. 175 (10): 3020–5. PMC 204621. PMID 8491720. Archived (PDF) from the original on 2007-09-27.
- ↑ 73.0 73.1 73.2 Boyer PD (1997). "The ATP synthase--a splendid molecular machine". Annu. Rev. Biochem. 66: 717–49. doi:10.1146/annurev.biochem.66.1.717. PMID 9242922.
- ↑ Van Walraven HS, Strotmann H, Schwarz O, Rumberg B (1996). "The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four". FEBS Lett. 379 (3): 309–13. doi:10.1016/0014-5793(95)01536-1. PMID 8603713.
- ↑ Yoshida M, Muneyuki E, Hisabori T (2001). "ATP synthase--a marvellous rotary engine of the cell". Nat. Rev. Mol. Cell Biol. 2 (9): 669–77. doi:10.1038/35089509. PMID 11533724.
- ↑ Schemidt RA, Qu J, Williams JR, Brusilow WS (1998). "Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli". J. Bacteriol. 180 (12): 3205–8. PMC 107823. PMID 9620972.
- ↑ Nelson N, Perzov N, Cohen A, Hagai K, Padler V, Nelson H (1 January 2000). "The cellular biology of proton-motive force generation by V-ATPases". J. Exp. Biol. 203 (Pt 1): 89–95. PMID 10600677. Archived from the original on 30 September 2007.
- ↑ Leslie AG, Walker JE (2000). "Structural model of F1-ATPase and the implications for rotary catalysis". Philos. Trans. R. Soc. Lond. B Biol. Sci. 355 (1396): 465–71. doi:10.1098/rstb.2000.0588. PMC 1692760. PMID 10836500.
- ↑ Noji H, Yoshida M (2001). "The rotary machine in the cell, ATP synthase". J. Biol. Chem. 276 (3): 1665–8. doi:10.1074/jbc.R000021200. PMID 11080505. Archived from the original on 2007-09-29.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ Capaldi RA, Aggeler R (2002). "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor". Trends Biochem. Sci. 27 (3): 154–60. doi:10.1016/S0968-0004(01)02051-5. PMID 11893513.
- ↑ Dimroth P, von Ballmoos C, Meier T (2006). "Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series". EMBO Rep. 7 (3): 276–82. doi:10.1038/sj.embor.7400646. PMC 1456893. PMID 16607397.
- ↑ Gresser MJ, Myers JA, Boyer PD (25 October 1982). "Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model". J. Biol. Chem. 257 (20): 12030–8. PMID 6214554. Archived from the original on 29 September 2007.
- ↑ Dimroth P (1994). "Bacterial sodium ion-coupled energetics". Antonie van Leeuwenhoek. 65 (4): 381–95. doi:10.1007/BF00872221. PMID 7832594.
- ↑ 84.0 84.1 Becher B, Müller V (1994). "Delta mu Na+ drives the synthesis of ATP via an delta mu Na(+)-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Gö1". J. Bacteriol. 176 (9): 2543–50. PMC 205391. PMID 8169202.
- ↑ Müller V (2004). "An exceptional variability in the motor of archael A1A0 ATPases: from multimeric to monomeric rotors comprising 6-13 ion binding sites". J. Bioenerg. Biomembr. 36 (1): 115–25. doi:10.1023/B:JOBB.0000019603.68282.04. PMID 15168615.
- ↑ Davies KJ (1995). "Oxidative stress: the paradox of aerobic life". Biochem. Soc. Symp. 61: 1–31. doi:10.1042/bss0610001. PMID 8660387.
- ↑ Rattan SI (2006). "Theories of biological aging: genes, proteins, and free radicals" (PDF). Free Radic. Res. 40 (12): 1230–8. doi:10.1080/10715760600911303. PMID 17090411. Archived from the original (PDF) on 2014-06-14. Retrieved 2017-10-27.
- ↑ Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J (2007). "Free radicals and antioxidants in normal physiological functions and human disease". Int. J. Biochem. Cell Biol. 39 (1): 44–84. doi:10.1016/j.biocel.2006.07.001. PMID 16978905.
- ↑ Raha S, Robinson BH (2000). "Mitochondria, oxygen free radicals, disease and ageing". Trends Biochem. Sci. 25 (10): 502–8. doi:10.1016/S0968-0004(00)01674-1. PMID 11050436.
- ↑ Finkel T, Holbrook NJ (2000). "Oxidants, oxidative stress and the biology of ageing". Nature. 408 (6809): 239–47. doi:10.1038/35041687. PMID 11089981.
- ↑ Kadenbach B, Ramzan R, Wen L, Vogt S (March 2010). "New extension of the Mitchell Theory for oxidative phosphorylation in mitochondria of living organisms". Biochim. Biophys. Acta. 1800 (3): 205–12. doi:10.1016/j.bbagen.2009.04.019. PMID 19409964.
- ↑ Echtay KS, Roussel D, St-Pierre J, Jekabsons MB, Cadenas S, Stuart JA, Harper JA, Roebuck SJ, Morrison A, Pickering S, Clapham JC, Brand MD (January 2002). "Superoxide activates mitochondrial uncoupling proteins". Nature. 415 (6867): 96–9. Bibcode:2002Natur.415...96E. doi:10.1038/415096a. PMID 11780125.
- ↑ Davies KJ (1995). "Oxidative stress: the paradox of aerobic life". Biochem. Soc. Symp. 61: 1–31. doi:10.1042/bss0610001. PMID 8660387.
- ↑ 94.0 94.1 Joshi S, Huang YG (1991). "ATP synthase complex from bovine heart mitochondria: the oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase". Biochim. Biophys. Acta. 1067 (2): 255–8. doi:10.1016/0005-2736(91)90051-9. PMID 1831660.
- ↑ Tsubaki M (1993). "Fourier-transform infrared study of cyanide binding to the Fea3-CuB binuclear site of bovine heart cytochrome c oxidase: implication of the redox-linked conformational change at the binuclear site". Biochemistry. 32 (1): 164–73. doi:10.1021/bi00052a022. PMID 8380331.
- ↑ Heytler PG (1979). "Uncouplers of oxidative phosphorylation". Meth. Enzymol. Methods in Enzymology. 55: 462–42. doi:10.1016/0076-6879(79)55060-5. ISBN 978-0-12-181955-2. PMID 156853.
- ↑ Lambert AJ, Brand MD (2004). "Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH:ubiquinone oxidoreductase (complex I)". J. Biol. Chem. 279 (38): 39414–20. doi:10.1074/jbc.M406576200. PMID 15262965. Archived from the original on 2007-09-29.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ Dervartanian DV, Veeger C (November 1964). "Studies on succinate dehydrogenase: I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes". Biochim. Biophys. Acta. 92 (2): 233–47. doi:10.1016/0926-6569(64)90182-8. PMID 14249115.
- ↑ Ricquier D, Bouillaud F (2000). "The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP". Biochem. J. 345 (2): 161–79. doi:10.1042/0264-6021:3450161. PMC 1220743. PMID 10620491.
- ↑ Borecký J, Vercesi AE (2005). "Plant uncoupling mitochondrial protein and alternative oxidase: energy metabolism and stress". Biosci. Rep. 25 (3–4): 271–86. doi:10.1007/s10540-005-2889-2. PMID 16283557.
- ↑ Harden A, Young WJ.; Young (1906). "The alcoholic ferment of yeast-juice". Proceedings of the Royal Society. B (77): 405–20. doi:10.1098/rspb.1906.0029.
- ↑ Kalckar HM (1974). "Origins of the concept oxidative phosphorylation". Mol. Cell. Biochem. 5 (1–2): 55–63. doi:10.1007/BF01874172. PMID 4279328.
- ↑ Lipmann F (1941). "Metabolic generation and utilization of phosphate bond energy". Adv Enzymol. 1: 99–162. doi:10.4159/harvard.9780674366701.c141. ISBN 9780674366701.
- ↑ Friedkin M, Lehninger AL (1 April 1949). "Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen". J. Biol. Chem. 178 (2): 611–44. PMID 18116985. Archived from the original on 16 December 2008.
- ↑ Kalckar, H. M. (1991). "50 years of biological research--from oxidative phosphorylation to energy requiring transport regulation". Annual Review of Biochemistry. 60: 1–37. doi:10.1146/annurev.bi.60.070191.000245. PMID 1883194.
{{cite journal}}: Cite has empty unknown parameter:|month=(help) - ↑ Belitser, V. A., Tsibakova, E. T. (1939). "About phosphorilation mechanism coupled with respiration". Biokhimya. 4: 516–534.
{{cite journal}}: Cite has empty unknown parameter:|month=(help)CS1 maint: multiple names: authors list (link) - ↑ Slater EC (1953). "Mechanism of phosphorylation in the respiratory chain". Nature. 172 (4387): 975–8. Bibcode:1953Natur.172..975S. doi:10.1038/172975a0. PMID 13111237.
- ↑ Mitchell P (1961). "Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism". Nature. 191 (4784): 144–8. Bibcode:1961Natur.191..144M. doi:10.1038/191144a0. PMID 13771349.
- ↑ Milton H. Saier Jr. "Peter Mitchell and the Vital Force". Archived from the original on 2014-07-14. Retrieved 2014-05-25.
- ↑ Mitchell, Peter (1978). "David Keilin's Respiratory Chain Concept and Its Chemiosmotic Consequences" (Pdf). Nobel lecture. Nobel Foundation. Archived (PDF) from the original on 2007-09-27. Retrieved 2007-07-21.
- ↑ Pullman ME, Penefsky HS, Datta A, Racker E (1 November 1960). "Partial resolution of the enzymes catalyzing oxidative phosphorylation. I. Purification and properties of soluble dinitrophenol-stimulated adenosine triphosphatase". J. Biol. Chem. 235 (11): 3322–9. PMID 13738472. Archived from the original on 29 September 2007.
- ↑ Gresser MJ, Myers JA, Boyer PD (25 October 1982). "Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model". J. Biol. Chem. 257 (20): 12030–8. PMID 6214554. Archived from the original on 29 September 2007.
- ↑ Boyer PD, Cross RL, Momsen W (1973). "A new concept for energy coupling in oxidative phosphorylation based on a molecular explanation of the oxygen exchange reactions". Proc. Natl. Acad. Sci. U.S.A. 70 (10): 2837–9. Bibcode:1973PNAS...70.2837B. doi:10.1073/pnas.70.10.2837. PMC 427120. PMID 4517936.
- ↑ "The Nobel Prize in Chemistry 1997". Nobel Foundation. Archived from the original on 2017-03-24. Retrieved 2007-07-21.
കൂടുതൽ വായനയ്ക്ക്
[തിരുത്തുക]ആമുഖം
[തിരുത്തുക]- Nelson DL; Cox MM (2004). Lehninger Principles of Biochemistry (4th ed.). W. H. Freeman. ISBN 0-7167-4339-6.
- Schneider ED; Sagan D (2006). Into the Cool: Energy Flow, Thermodynamics and Life (1st ed.). University of Chicago Press. ISBN 0-226-73937-6.
- Lane N (2006). Power, Sex, Suicide: Mitochondria and the Meaning of Life (1st ed.). Oxford University Press, USA. ISBN 0-19-920564-7.
Advanced
[തിരുത്തുക]- Nicholls DG; Ferguson SJ (2002). Bioenergetics 3 (1st ed.). Academic Press. ISBN 0-12-518121-3.
- Haynie D (2001). Biological Thermodynamics (1st ed.). Cambridge University Press. ISBN 0-521-79549-4.
- Rajan SS (2003). Introduction to Bioenergetics (1st ed.). Anmol. ISBN 81-261-1364-2.
- Wikstrom M (Ed) (2005). Biophysical and Structural Aspects of Bioenergetics (1st ed.). Royal Society of Chemistry. ISBN 0-85404-346-2.
ജനറൽ ഉറവിടങ്ങൾ
[തിരുത്തുക]- Animated diagrams illustrating oxidative phosphorylation Wiley and Co Concepts in Biochemistry
- On-line biophysics lectures Archived 2009-05-02 at the Wayback Machine. Antony Crofts, University of Illinois at Urbana–Champaign
- ATP Synthase Graham Johnson
ഘടന ഉറവിടങ്ങൾ
[തിരുത്തുക]- PDB molecule of the month:
- ATP synthase Archived 2020-07-24 at the Wayback Machine.
- Cytochrome c Archived 2020-07-24 at the Wayback Machine.
- Cytochrome c oxidase Archived 2020-07-24 at the Wayback Machine.
- Interactive molecular models at Universidade Fernando Pessoa:
കുറിപ്പുകൾ
[തിരുത്തുക]
- ↑ DNP was extensively used as an anti-obesity medication in the 1930s but was ultimately discontinued due to its dangerous side effects. However, illicit use of the drug for this purpose continues today. See 2,4-Dinitrophenol#Dieting aid for more information.







![{\displaystyle {\ce {O2->[{\ce {e^{-}}}]{\underset {Superoxide}{O2^{\underline {\bullet }}}}->[{\ce {e^{-}}}]{\underset {Peroxide}{O2^{2-}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3d9bf9d3a61736aa6207fa53b8ce0165b9eebb6)
