അസറ്റിക് അമ്ലം
| |||

| |||
| Names | |||
|---|---|---|---|
| IUPAC name
അസറ്റിക് അമ്ലം
| |||
| Systematic IUPAC name
എഥനോയിക് അമ്ലം | |||
| Other names
അസറ്റൈൽ ഹൈഡ്രോക്സൈഡ് (AcOH), ഹൈഡ്രജൻ അസറ്റേറ്റ് (HAc), എഥൈയിലിക് അമ്ലം, മീഥെയ്ൻകാർബോക്സിലിക് അമ്ലം
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.000.528 | ||
| E number | E260 (preservatives) | ||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| InChI | |||
| SMILES | |||
| Properties | |||
| തന്മാത്രാ വാക്യം | |||
| Molar mass | 0 g mol−1 | ||
| Appearance | നിറമില്ലാത്ത ദ്രാവകം അല്ലെങ്കിൽ പരലുകളായി | ||
| സാന്ദ്രത | 1.049 g·cm−3 (l) 1.266 g·cm−3 (s) | ||
| ദ്രവണാങ്കം | |||
| ക്വഥനാങ്കം | |||
| Fully miscible | |||
| അമ്ലത്വം (pKa) | 4.76 at 25 °C | ||
| വിസ്കോസിറ്റി | 1.22 mPa·s at 25 °C | ||
| Structure | |||
| 1.74 D (gas) | |||
| Hazards | |||
| EU classification | {{{value}}} | ||
| R-phrases | R10, R35 | ||
| S-phrases | (S1/2), S23, S26, S45 | ||
| Flash point | {{{value}}} | ||
| Related compounds | |||
| Related കാർബോക്സിലിക് അമ്ലം | ഫോമിക് അമ്ലം, Propionic acid, ബ്യൂട്ടൈറിക് അമ്ലം | ||
| Related compounds | അസറ്റാമൈഡ്, എഥൈൽ അസറ്റേറ്റ്, അസറ്റൈൽ ക്ലോറൈഡ്, അസെറ്റിക് അൺഹൈഡ്രൈഡ്, acetonitrile, acetaldehyde, എഥനോൾ, thioacetic acid | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
ദുർബല അമ്ലമായ ഒരു ഓർഗാനിക് സംയുക്തമാണ് അസറ്റിക് അമ്ലം. ഇതിൻറെ രാസസമവാക്യം CH3COOH ആണ്. ശുദ്ധമായ അസറ്റിക് അമ്ലം നിറമില്ലാത്ത ദ്രാവകമായി കാണപ്പെടുന്നു. ഇത് 16.5 ഡിഗ്രി സെൽഷ്യസിൽ ഖനീഭവിക്കുമ്പോൾ നിറമില്ലാത്ത ക്രിസ്റ്റലാകൃതിയുള്ള ഖരമായി മാറുന്നു.
വ്യാവസായിക രസതന്ത്രത്തിലെ ഏറ്റവും പ്രധാനപ്പെട്ട കെമിക്കൽ റീഏജൻറുകളിലൊന്നായ അസറ്റിക് അമ്ലം ലളിതമായ കാർബോക്സിലിക് അമ്ലങ്ങളിലൊന്നാണ്. ശീതള പാനീയങ്ങളിലുപയോഗിക്കുന്ന പോളിഎഥിലീൻ ടെറാഫ്താലേറ്റ്, ഫോട്ടോഗ്രാഫിക് ഫിലിമിലുപയോഗിക്കുന്ന സെല്ലുലോസ് അസറ്റേറ്റ്, മരപ്പശയിൽ ഉപയോഗിക്കുന്ന പോളിവിനൈൽ ക്ലോറൈഡ് എന്നിവ വ്യാവസായികമായി നിർമ്മിക്കാൻ അസെറ്റിക് അമ്ലം ഉപയോഗിക്കുന്നു.
6.5 മില്യൺ ടൺ പ്രതി വർഷം(Mt/a) എന്നതാണ് ആഗോളമായുള്ള അസെറ്റിക് അമ്ലത്തിൻറെ ആവശ്യം. ഇതിൽ 1.5 Mt/a റീസൈക്ലിങ് മുഖേനയാണ് ഉത്പാദിപ്പിക്കുന്നത്. ബാക്കി പെട്രോകെമിക്കൽ സംഭരണങ്ങളിൽ നിന്നും ജൈവ ഉറവിടങ്ങളിൽ നിന്നുമാണ് ഉത്പാദിപ്പിക്കുന്നത്. സ്വാഭാവിക പുളിപ്പിക്കൽ വഴിയാണ് ഡയല്യൂട്ട് അസെറ്റിക് അമ്ലം ഉത്പാദിപ്പിക്കുന്നത്. വിന്നാഗിരി എന്ന പേരിലാണ് ഗാർഹികമായി ഇതറിയപ്പെടുന്നത്.കള്ള് അധികമായി പുളിച്ചുകഴിയുമ്പോൾ കിട്ടുന്നത് വിന്നാഗിരിയാണ്.
നാമകരണം
[തിരുത്തുക]അസെറ്റം എന്ന ലാറ്റിൻ പദത്തിൽ നിന്നാണ് അസറ്റിക് എന്ന പേര് ഉത്ഭവിച്ചത്. ലത്തീൻ ഭാഷയിൽ വിന്നാഗിരി എന്നാണ് ഇതിനർത്ഥം.
രാസഗുണങ്ങൾ
[തിരുത്തുക]അസറ്റിക് അമ്ലത്തിലുള്ള കാർബോക്സിലിക് ഗ്രൂപ്പിലെ(−COOH) ഹൈഡ്രജൻ ആറ്റമാണ് അമ്ല സ്വഭാവം നൽകുന്നത്. ഇതൊരു ദുർബല അമ്ലമാണ്. ജലീയലായനിയിൽ മോണോപ്രോട്ടിക് അമ്ലമായി ഇത് വർത്തിക്കുന്നു,pKa മൂല്യം 4.75 ആണ്. അസറ്റേറ്റാണ്(CH3COO−) ഇതിൻറെ കോഞ്ചുഗേറ്റ് ക്ഷാരം.

അസെറ്റിക് അമ്ലത്തിൻറെ ക്രിസ്റ്റൽ ഘടന വ്യക്തമാക്കുന്നത് മോളിക്യൂളുകൾ ജോടികളായി ഡൈമറുകളാവുകയും ഈ ഡൈമറുകൾ ഹൈഡ്രജനുമായി ബന്ധനത്തിലാവുകയും ചെയ്യുന്നു.[1].
എഥനോൾ ,ജലം എന്നിവയെപ്പോലെ ദ്രവീയ അസെറ്റിക് അമ്ലം ഒരു ഹൈഡ്രോഫിലിക് പ്രോട്ടിക് ലായകമാണ്.
രാസപ്രവർത്തനങ്ങൾ
[തിരുത്തുക]നിർമ്മാണം
[തിരുത്തുക]
ബാക്ടീരിയൽ ഫെർമെൻറേഷൻ വഴിയാണ് അസറ്റിക് അമ്ലം നിർമ്മിക്കുന്നത്. രാസവ്യവസായത്തിൽ 75 ശതമാനം അസറ്റിക് അമ്ലം നിർമ്മിക്കുന്നത് മെഥനോൾ കാർബോണലൈസേഷൻ വഴിയാണ്[2]. പ്രതിവർഷം 5 മില്യൺ ടൺ ആണ് ലോകത്തെ മൊത്ത ഉല്പാദനം. ഇതിൽ പകുതിയും നിർമ്മിക്കുന്നത് അമേരിക്കയാണ്. സെലാനീസ്, ബിപി കെമിക്കൽസ് എന്നിവരാണ് മുഖ്യ നിർമ്മാതാക്കൾ. മില്ലേനിയം കെമിക്കൽസ്, സ്റ്റെർലിങ് കെമിക്കൽസ്, സാംസംഗ്, ഈസ്റ്റ്മാൻ എന്നിവരാണ് മറ്റ് നിർമ്മാതാക്കൾ.
മെഥനോൾ കാർബോണലൈസേഷൻ
[തിരുത്തുക]മെഥനോൾ കാർബോണലൈസേഷൻ വഴിയാണ് അസറ്റിക് അമ്ലം മുഖ്യമായും നിർമ്മിക്കുന്നത്. ഇവിടെ മെഥനോളും കാർബൺ മോണോക്സൈഡും തമ്മിൽ പ്രവർത്തിച്ച് അസറ്റിക് അമ്ലം ഉണ്ടാവുന്നു.
- CH3OH + CO → CH3COOH
പ്രക്രിയയിൽ അയഡോമെഥെയൻ മധ്യമമായി ഉപയോഗിക്കുന്നു. മൂന്ന് ഘട്ടങ്ങളായമാണ് പ്രക്രിയ നടക്കുന്നത്. രണ്ടാം ഘട്ടമായ കാർബോണലൈസേഷന് അഭികാരകം അത്യാവശ്യമാണ്. ഏതെങ്കിലും ലോഹ കോംപ്ലക്സ് അഭികാരകമായി ഉപയോഗിക്കുന്നു.
- (1) CH3OH + HI → CH3I + H2O
- (2) CH3I + CO → CH3COI
- (3) CH3COI + H2O → CH3COOH + HI
ഈ പ്രക്രിയയിൽ തന്നെ അസെറ്റിക് അൺഹൈഡ്രൈഡ് ഉത്പാദിപ്പിക്കാവുന്നതാണ്.
അസറ്റാൽഡിഹൈഡ് ഓക്സിഡേഷൻ
[തിരുത്തുക]ഉപയോഗങ്ങൾ
[തിരുത്തുക]
വിവിധ രാസസംയുക്തങ്ങളുടെ നിർമ്മാണത്തിനായുള്ള കെമിക്കൽ റീഏജൻറായി അസെറ്റിക് അമ്ലം ഉപയോഗിക്കുന്നു. എന്നാൽ വിനൈൽ അസറ്റേറ്റ് മോണോമെറിൻറെ നിർമ്മാണത്തിനാണ് കുടുതലായും അസെറ്റിക് അമ്ലം ഉപയോഗിക്കുന്നത്. എന്നാൽ വിന്നാഗിരിയിലുപയോഗിക്കുന്ന അസെറ്റിക് അമ്ലത്തിൻറെ അളവ് താരതമ്യേന കുറവാണ്[3].
വൈനൈൽ അസറ്റേറ്റ് മോണോമെർ
[തിരുത്തുക]അസെറ്റിക് അമ്ലത്തിൻറെ പ്രധാന ഉപയോഗങ്ങളിലൊന്നാണ് വൈനൈൽ അസറ്റേറ്റ് മോണോമെറിൻറെ (VAM) നിർമ്മാണം. ലോകത്തിലെ അസെറ്റിക് അമ്ലത്തിൻറെ മൊത്ത ഉല്പാദനത്തിൻറെ 40-45 ശതമാനം ഈയാവശ്യത്തിനാണ് ഉപയോഗിക്കുന്നത്. ഇതിൽ അസെറ്റിക് അമ്ലവും എഥിലീനും ഓക്സിജൻറെ സാനിധ്യത്തിൽ പ്രവർത്തിക്കുന്നു. ഇവിടെ പലേഡിയം ഉൽപ്രേരകമായി ഉപയോഗിക്കുന്നു.
- 2 H3C-COOH + 2 C2H4 + O2 → 2 H3C-CO-O-CH=CH2 + 2 H2O
വൈനൈൽ അസറ്റേറ്റ് പോളിമറൈസേഷന് വിധേയമാക്കി പോളിവൈനൈൽ അസറ്റേറ്റ് നിർമ്മിക്കാവുന്നതാണ്.
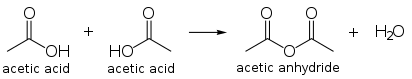
അസെറ്റിക് അൺഹൈഡ്രൈഡ്
[തിരുത്തുക]രണ്ട് അസെറ്റിക് അമ്ലത്തിൻറെ കണ്ടൻസേഷൻ ഉല്പന്നമാണ് അസെറ്റിക് അൺഹൈഡ്രൈഡ്. ലോകത്താകെയുളള അസെറ്റിക് അൺഹൈഡ്രൈഡിൻറെ ഉല്പാദനം അസെറ്റിക് അമ്ലത്തിൻറെ പ്രധാന ഉപയോഗങ്ങളിലൊന്നാണ്. അസെറ്റിക് അമ്ലത്തിൻറെ 25-30 ശതമാനം ഇതിനുപയോഗിക്കുന്നു. എന്നാൽ അസെറ്റിക് അമ്ലത്തിൻറെ നിർമ്മാണ പ്രക്രിയായ മെഥനോൾ കാർബണലൈസേഷനിൽ വെച്ച് ഉപോല്പന്നമായി അസെറ്റിക് അൺഹൈഡ്രൈഡ് നിർമ്മിക്കാവുന്നതാണ്.
അസെറ്റിക് അൺഹൈഡ്രൈഡ് ഒരു ശക്തിയേറിയ അസറ്റലൈസേഷൻ റീഏജൻറാണ്. ആസ്പിരിൻ, ഹെറോയിൻ എന്നിവയുടെ നിർമ്മാണത്തിലെ റീഏജന്റാണ് ഇത്. സെല്ലുലോസ് അസറ്റേറ്റാണ് ഇതിൻറെ പ്രധാന ഉപയോഗം.
സുരക്ഷ
[തിരുത്തുക]ഗാഢ അസെറ്റിക് അമ്ലം വളരെ അപകടകാരിയാണ്. അതിനാൽ വളരെയധികം ജാഗ്രത ഇത് കൈകാര്യം ചെയ്യുമ്പോൾ കാണിക്കേണ്ടതുണ്ട്. തൊലി പൊള്ളൽ, നേത്രത്തിന് ക്ഷതം എന്നിവയെല്ലാം ശരീരത്ത് അമ്ലം വീഴുമ്പോൾ സംഭവിക്കാവുന്നതാണ്.
| ഗാഢത ഭാരമനുസരിച്ച് |
മൊളാരിറ്റി | വർഗ്ഗീകരണം | R-Phrases |
|---|---|---|---|
| 10–25% | 1.67–4.16 mol/L | Irritant (Xi) | R36/38 |
| 25–90% | 4.16–14.99 mol/L | Corrosive (C) | R34 |
| >90% | >14.99 mol/L | Corrosive (C) ജ്വലിക്കുന്നത് (F) | R10, R35 |
പുറം കണ്ണികൾ
[തിരുത്തുക]- International Chemical Safety Card 0363
- National Pollutant Inventory - അസറ്റിക് അമ്ലം fact sheet Archived 2006-11-14 at the Wayback Machine.
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US Permissible exposure limits)
- ChemSub Online: CAS Number 64-19-7, Acetic acid Archived 2010-01-14 at the Wayback Machine.
- Usage of acetic acid in Organic Syntheses
- Acetic acid pH and titration - freeware for data analysis, simulation and distribution diagram generation
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of അസറ്റിക് അമ്ലം
അവലംബം
[തിരുത്തുക]- ↑ Jones, R.E. (1958). "അസെറ്റിക് അമ്ലത്തിൻറെ ക്രിസ്റ്റൽ ഘടന". Acta Crystallogr. 11 (7): 484–87. doi:10.1107/S0365110X58001341.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Yoneda, N. (2001). "Recent advances in processes and catalysts for the production of acetic acid". Applied Catalysis A, General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്;sureshഎന്ന പേരിലെ അവലംബങ്ങൾക്ക് എഴുത്തൊന്നും നൽകിയിട്ടില്ല.