വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തം
വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തം (Valence shell electron pair repulsion (VSEPR) theory) എന്നത് രസതന്ത്രത്തിൽ തന്മാത്രകളുടെ മധ്യത്തിലുള്ള അണുക്കളെ വലയം ചെയ്തിരിക്കുന്ന ഇലക്ട്രോൺ ജോഡികളുടെ എണ്ണത്തിൽ നിന്ന് തന്മാത്രകളുടെ ജ്യാമിതി പ്രവചിക്കുന്നതിന് ഉപയോഗിക്കുന്ന ഒരു മാതൃകയാണ്. [1] ഈ സിദ്ധാന്തം രൂപപ്പെടുത്തിയ ശാസ്ത്രജ്ഞരോടുള്ള ബഹുമാനാർത്ഥം ഇതിനെ Gillespie–Nyholm theory എന്നും വിളിക്കുന്നു. വി.എസ്.ഇ.പി.ആർ എന്ന സംക്ഷേപം "ves-per" [2]എന്നോ "vuh-seh-per" [3]എന്നോ ചില രസതന്ത്രജ്ഞർ ഉച്ചരിക്കുന്നു.
വി.എസ്.ഇ.പി.ആർ അനുസരിച്ച് ഒരു ആറ്റത്തെ വലയം ചെയ്തിരിക്കുന്ന ബാഹ്യതമ ഇലക്ട്രോൺ ജോഡികൾ തമ്മിൽ വികർഷിക്കാനുള്ള ഒരു പ്രവണത കാണിക്കുന്നു. അവ വികർഷണം കുറയ്ക്കുന്ന തരം ക്രമീകരണത്തിൽ എത്തുന്നു. ഇങ്ങനെ അവയുടെ തന്മാത്രാജ്യാമിതി നിർണ്ണയിക്കാം. Gillespie യുടെ വാദമനുസരിച്ച്, തന്മാത്രാജ്യാമിതി നിർണ്ണയിക്കാനായി ഇലക്ട്രൊസ്റ്റാറ്റിക് വികർഷണത്തേക്കാൾ പോളി എക്സ്ക്ലൂഷൻ തത്ത്വമനുസരിച്ചുള്ള ഇലക്ട്രോണും ഇലക്ട്രോണുമായുള്ള വികർഷണം കൂടുതൽ പ്രധാനമാണ്.[4]
വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തം ഗണിതപരമായ തരംഗപ്രവർത്തനത്തേക്കാൾ നിരീക്ഷിക്കാവുന്ന ഇലക്ട്രോൺ സാന്ദ്രതയെ അടിസ്ഥാനമാക്കിയിരിക്കുന്നു. ആയതിനാൽ, ഓർബിറ്റൽ ഹൈബ്രിഡൈസേഷനുമായി ബന്ധമുള്ളതല്ല.[5] എന്നിരുന്നാലും, രണ്ടും തന്മാത്രാരൂപത്തെ അഭിമുഖീകരിക്കുന്നുണ്ട്. അത് അപ്പോൾ പ്രധാനമായും ഗുണാത്മകമായ അടിസ്ഥാനത്തിൽ ഉള്ളതാണെങ്കിൽ വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തം പരിമാണത്തിന്റെ അടിസ്ഥാനത്തിലുള്ള quantum chemical topology (QCT) രീതികളായ electron localization function and the quantum theory of atoms in molecules (QTAIM) എന്നിവയിലുള്ളതാകുന്നു.[4]
പൊതുവായ അവലോകനം
[തിരുത്തുക]തന്മാത്രകളിലെ ഹൈഡ്രജനല്ലാത്ത അണുക്കൾക്കു ചുറ്റുമുള്ള ഇലക്ട്രോൺ ജോഡികളുടെ ക്രമീകരണം പ്രവചിക്കാനാണ് വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തം ഉപയോഗിക്കുന്നത്.
തന്മാത്രയുടെ Lewis structure വരച്ച്, ബന്ധിക്കപ്പെട്ടവയും ഒറ്റയ്ക്കു നിൽക്കുന്നതുമായ ഇലക്ട്രോണുകളുടെ ജോഡികൾ പ്രദർശിപ്പിക്കും വിധം ഇതിനെ വികസിപ്പിച്ച് മധ്യത്തിലുള്ള ഒരു ആറ്റത്തിന്റെ ബാഹ്യതമ ഷെല്ലിലെ ഇലക്ട്രോൺ ജോഡികളുടെ എണ്ണം നിർണ്ണയിക്കാം.[6] വി.എസ്.ഇ.പി.ആർ സിദ്ധാന്തത്തിൽ ഒരു ദ്വിബന്ധനമോ ത്രിബന്ധനമോ ഒരു ഏകബന്ധന ഗണമായി പരിഗണിക്കപ്പെടുന്നു.[6] മധ്യത്തിലുള്ള ആറ്റവുമായി ബന്ധിക്കപ്പെട്ട ആറ്റങ്ങളുടെ എണ്ണത്തിന്റേയും ബന്ധിക്കപ്പെടാത്ത ബാഹ്യതമ ഇലക്ട്രോണുകളാൽ രൂപപ്പെടുന്ന lone pair കളുടെ എണ്ണത്തിന്റേയും തുകയെ മധ്യത്തിലുള്ള ആറ്റത്തിന്റെ steric number എന്നു പറയുന്നു.
AXE രീതി
[തിരുത്തുക]വി.എസ്.ഇ.പി.ആർ തത്ത്വം ഉപയോഗിക്കുമ്പോൾ AXE രീതിയിലുള്ള ഇലക്ട്രോൺ എണ്ണൽ രീതി സാധാരണയുപയോഗിക്കുന്നു.
| Steric No. |
Molecular geometry[7] 0 lone pair |
Molecular geometry[7] 1 lone pair |
Molecular geometry[7] 2 lone pairs |
Molecular geometry[7] 3 lone pairs |
|---|---|---|---|---|
| 2 | ||||
| 3 |  |
 |
||
| 4 |  |
 |
 |
|
| 5 |  |
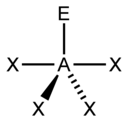 |
 |
 3) |
| 6 |  |
 |
 |
|
| 7 |  |
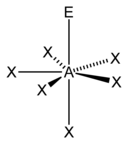 5)[9] |
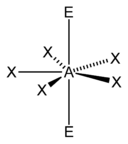 5)[10] |
|
| 8 | (TaF3− 8)[8] |
|||
| 9 | Tricapped trigonal prismatic (ReH2− 9)[11] OR Capped square antiprismatic[അവലംബം ആവശ്യമാണ്] |
|||
| 10 | Bicapped square antiprismatic OR Bicapped dodecadeltahedral[12] |
|||
| 11 | Octadecahedral[12] | |||
| 12 | Icosahedral[12] | |||
| 13 | ||||
| 14 | Bicapped hexagonal antiprismatic[12] |
| Molecule Type | Shape[7] | Electron arrangement†[7] | Geometry‡[7] | Examples |
|---|---|---|---|---|
| AX2E0 | Linear | BeCl2,[1] HgCl2,[1] CO2[8] | ||
| AX2E1 | Bent | 
|

|
NO− 2,[1] SO2,[7] O3,[1] CCl2 |
| AX2E2 | Bent | 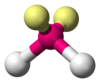
|

|
H2O,[7] OF2[13] |
| AX2E3 | Linear | 
|
XeF2,[7] I− 3,[14] XeCl2 | |
| AX3E0 | Trigonal planar | 
|

|
BF3,[7] CO2− 3,[15] NO− 3,[1] SO3[8] |
| AX3E1 | Trigonal pyramidal | 
|

|
NH3,[7] PCl3[16] |
| AX3E2 | T-shaped | 
|

|
ClF3,[7] BrF3[17] |
| AX4E0 | Tetrahedral | 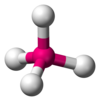
|

|
CH4,[7] PO3− 4, SO2− 4,[8] ClO− 4,[1] XeO4[18] |
| AX4E1 | Seesaw (also called disphenoidal) | 
|
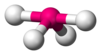
|
SF4[7][19] |
| AX4E2 | Square planar | 
|

|
XeF4[7] |
| AX5E0 | Trigonal bipyramidal | 
|

|
PCl5[7] |
| AX5E1 | Square pyramidal | 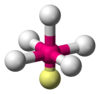
|

|
ClF5,[17] BrF5,[7] XeOF4[8] |
| AX5E2 | Pentagonal planar | 
|

|
XeF− 5[10] |
| AX6E0 | Octahedral | 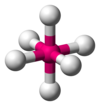
|

|
SF6,[7] WCl6[20] |
| AX6E1 | Pentagonal pyramidal | 
|

|
XeOF− 5,[9] IOF2− 5[9] |
| AX7E0 | Pentagonal bipyramidal[8] | 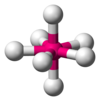
|

|
IF7[8] |
| AX8E0 | Square antiprismatic[8] | 
|

|
IF− 8, ZrF4− 8, ReF− 8 |
| AX9E0 | Tricapped trigonal prismatic (as drawn) OR capped square antiprismatic |
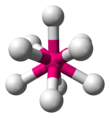
|

|
ReH2− 9[11] |
ഇതും കാണുക
[തിരുത്തുക]- Bent's rule (effect of ligand electronegativity)
- Linear combination of atomic orbitals
- Molecular geometry
- Molecular modelling
- Software for molecular modeling
- Thomson problem
- Valency interaction formula
അവലംബം
[തിരുത്തുക]- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Jolly, W. L.,Modern Inorganic Chemistry, McGraw-Hill, 1984, p.77-90. ISBN 0-07-032760-2
- ↑ Petrucci R.H., Harwood W.S. and Herring F.G. General Chemistry: Principles and Modern Applications (Prentice-Hall 8th ed. 2002) p.410 ISBN 0-13-014329-4
- ↑ H. Stephen Stoker (2009). General, Organic, and Biological Chemistry. Cengage Learning. p. 119. ISBN 978-0-547-15281-3.
- ↑ 4.0 4.1 R.J. Gillespie (2008), Coordination Chemistry Reviews vol.252, pp.1315-1327, Fifty years of the VSEPR model
- ↑ Gillespie, R.J. (2004), "Teaching molecular geometry with the VSEPR model", Journal of Chemical Education, 81 (3): 298–304, Bibcode:2004JChEd..81..298G, doi:10.1021/ed081p298
- ↑ 6.0 6.1 R.H. Petrucci, W.S. Harwood and F.G. Herring, General Chemistry (8th ed., Prentice-Hall 2002) pp.410-417. ISBN 0-13-014329-4
- ↑ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 7.10 7.11 7.12 7.13 7.14 7.15 7.16 7.17 7.18 Steric numbers 2-6 from R.H. Petrucci, W.S. Harwood and F.G. Herring, General Chemistry (8th ed., Prentice-Hall 2002) Table 11.1, pp.413-414. ISBN 0-13-014329-4
- ↑ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 8.8 G.L. Miessler and D.A. Tarr, Inorganic Chemistry (2nd ed., Prentice-Hall 1999) pp.54-62. ISBN 0-13-841891-8
- ↑ 9.0 9.1 9.2 Baran, E. (2000). "Mean amplitudes of vibration of the pentagonal pyramidal XeOF5− and IOF52− anions". Journal of Fluorine Chemistry. 101: 61–63. doi:10.1016/S0022-1139(99)00194-3.
- ↑ 10.0 10.1 ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്;House498എന്ന പേരിലെ അവലംബങ്ങൾക്ക് എഴുത്തൊന്നും നൽകിയിട്ടില്ല. - ↑ 11.0 11.1 ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്;House254എന്ന പേരിലെ അവലംബങ്ങൾക്ക് എഴുത്തൊന്നും നൽകിയിട്ടില്ല. - ↑ 12.0 12.1 12.2 12.3 ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്;stericnoover9എന്ന പേരിലെ അവലംബങ്ങൾക്ക് എഴുത്തൊന്നും നൽകിയിട്ടില്ല. - ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.448
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.483
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.368
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.407
- ↑ 17.0 17.1 Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.481
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.499
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.45. This source uses the name disphenoidal.
- ↑ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2), p.659
കൂടുതൽ വായനയ്ക്ക്
[തിരുത്തുക]- Chemistry: Foundations and Applications. J. J. Lagowski, ed. New York: Macmillan, 2004. ISBN 0-02-865721-7. Volume 3, pages 99–104.
പുറം കണ്ണികൾ
[തിരുത്തുക]
പരിശീലനക്കുറിപ്പുകൾ A-level Chemistry/OCR (Salters) എന്ന താളിൽ ലഭ്യമാണ്
- 3D Chem - Chemistry, Structures, and 3D Molecules
- IUMSC - Indiana University Molecular Structure Center
