അതിസംയുഗ്മനം
ഈ ലേഖനം ഏതെങ്കിലും സ്രോതസ്സുകളിൽ നിന്നുള്ള വേണ്ടത്ര തെളിവുകൾ ഉൾക്കൊള്ളുന്നില്ല. ദയവായി യോഗ്യങ്ങളായ സ്രോതസ്സുകളിൽ നിന്നുമുള്ള അവലംബങ്ങൾ ചേർത്ത് ലേഖനം മെച്ചപ്പെടുത്തുക. അവലംബമില്ലാത്ത വസ്തുതകൾ ചോദ്യം ചെയ്യപ്പെടുകയും നീക്കപ്പെടുകയും ചെയ്തേക്കാം. |
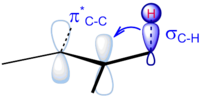
ഓർഗാനിക് സംയുക്തത്തിലെ ബന്ധനത്തിൽ ഏർപ്പെട്ടിരിക്കുന്ന സിഗ്മ ഇലക്ട്രോണുകളുടെ വിസ്ഥാപനമാണ് (Dislocation) അതിസംയുഗ്മനം (Hyperconjugation). ഇതിനെ സിഗ്മ സംയുഗ്മനം (Sigma conjugation) എന്നും വിളിക്കുന്നു. ബന്ധനത്തിലേർപ്പെടാത്ത അടുത്തു സ്ഥിതിചെയ്യുന്ന പ്രതിബന്ധന സിഗ്മ (Antibonding orbital)അല്ലെങ്കിൽ പൈ ഓർബിറ്റലുകളുമായുള്ള സംവാദം അഥവാ ഇൻററാക്ഷൻ ആണ് അതിസംയുഗ്മനം. ഇത് പുതിയ ഉത്തേജിത തന്മാത്രാ കക്ഷീയങ്ങൾ (Molecular orbits) ഉണ്ടാകാൻ കാരണമാകുന്നു. അതിസംയുഗ്മനം വഴി സംഭവിക്കുന്ന ഇലക്ട്രോൺ വിസ്ഥാപനം വ്യൂഹത്തിന്റെ സ്ഥിരത വർദ്ധിപ്പിക്കുന്നു. അതായത് അതിസംയുഗ്മന ഘടനകളുടെ എണ്ണം വർദ്ധിക്കുന്നതിനനുസൃതമായി സംയുക്തത്തിന്റെ അഥവാ വ്യൂഹത്തിന്റെ സ്ഥിരത വർദ്ധിക്കുന്നു.[1] .[2][3] ഇരട്ടഅതിസംയുഗ്മനം (Double hyperconjugation[4]) എന്ന അതിസംയുഗ്മനവും പ്രാതിനിധ്യം അർഹിക്കുന്നതാണ്. ചില പ്രത്യേക രാസപ്രവർത്തന ഘടനവിവരിക്കുന്ന[5] അതിസംയുഗ്മന രാസപ്രവർത്തനത്തെ ബേക്കർ-നാതൻ പ്രഭാവം[6] എന്നും വിളിക്കുന്നു.
പ്രായോഗികത[തിരുത്തുക]
ആനോമെറിക് പ്രഭാവം, ഗോഷ് പ്രഭാവം, ഈതെയ്ൻ സംയുക്തത്തിന്റെ പരിക്രമണ തടസ്സം അഥവാ ഈതെയ്നിന്റെ പരിക്രമണ പ്രതിബന്ധങ്ങൾ (Rotational barriers), ബീറ്റാ സിലിക്കൺ പ്രഭാവം, ബഹിർചാക്രിക കാർബോണിൽ (Exocyclic carbonyl group) കമ്പനാവൃത്തി (Vibrational frequency), പൂരിത കാർബോകാറ്റയോണുകളുടെയും പൂരിത കാർബൺ കേന്ദ്രീകൃത റാഡിക്കലുകളുടെയും ആപേക്ഷിക സ്ഥിരത, ആൽക്കീൻ സ്ഥിരതയുടെ സെയ്റ്റ്സഫ് താപഗതിക നിയമം എന്നിവ വിശദീകരിക്കാൻ അതിസംയുഗ്മനത്തെ പ്രയോജനപ്പെടുത്താറുണ്ട്. സ്റ്റെറിക് തടസ്സത്തേക്കാൾ (Steric hinderance) കൂടുതൽ വ്യക്തമായി സ്റ്റാഗേർഡ് കൺഫർമേഷനുകളെ (അന്തരിത സംരൂപണം) വിശദീകരിക്കാൻ ഇവയ്ക്ക് സാധിക്കുമെന്നതിനാൽ തന്നെ ക്വാണ്ടം ബലതന്ത്രം അതിസംയുഗ്മനത്തിന് കൂടുതൽ പ്രാധാന്യം നൽകുന്നു.[7][8]
മറ്റു ഗുണങ്ങളിൽ അതിസംയുഗ്മനത്തിന്റെ പങ്ക്[തിരുത്തുക]
അതിസംയുഗ്മനം കുറെ ഗുണങ്ങളെ ബാധിക്കുന്നുണ്ട്. അവ ചുവടെ തന്നിരിക്കുന്നു.[9][10]
- ബോണ്ട് നീളം (ബന്ധന നീളം) : സിഗ്മ ബന്ധനങ്ങളുടെ നീളത്തിനുള്ള കുറവിന്റെ കാരണം അതിസംയുഗ്മനം ആണ്. 1,3-ബ്യൂട്ടാഡൈഈൻ, പ്രൊപ്പൈൻ എന്നീ ഹൈഡ്രോകാർബണുകളിലെ കാർബൺ-കാർബൺ ഏകബന്ധനങ്ങളുടെ ബോണ്ട് നീളം 1.46 Å ആണ്. പക്ഷെ അത് പൂരിത ഹൈഡ്രോകാർബണുകളിലെ 1.54 Å എന്ന അളവിനേക്കാൾ ചെറുതാണ്. ബ്യൂട്ടാഡൈഈനിൽ അത് സാധാരണ യുഗ്മനത്തിന്റെ (Normal conjugation) അടിസ്ഥാനത്തിൽ വിശദീകരിക്കാം. പക്ഷെ പ്രൊപ്പൈനിൽ ആൽക്കൈൻ-ആൽക്കൈനൈൽ ഭാഗങ്ങൾക്കിടയിലെ അതിസംയുഗ്മനം ആണ് വിശദീകരിക്കാൻ ഉപയോഗിക്കുന്നത്.
- ദ്വിധ്രുവ ആഘൂർണ്ണം (Dipole moments): ക്ലോറോഫോമിനെ അപേക്ഷിച്ച് 1,1,1-ട്രൈക്ലോറോഈതെയ്ൻ എന്ന സംയുക്തത്തിൽ കാണപ്പെടുന്ന വർദ്ധിച്ച ദ്വിധ്രുവ ആഘൂർണ്ണം അതിസംയുഗ്മന ഘടനകളുടെ അടിസ്ഥാനത്തിൽ മനസ്സിലാക്കാം.
- അതിസംയുഗ്മനം വഴി രൂപീകൃതമാകുന്ന എഥിലിൻ തന്മാത്രകളുടെ താപം അവയുടെ ബന്ധനോർജ്ജത്തിന്റെ (ബോണ്ട് ഊർജ്ജം) തുകയേക്കാൾ കൂടുതലും, അതുപോലെ പ്രതി ദ്വിബന്ധനത്തിലെ ഹൈഡ്രജനീകരണ താപത്തേക്കാൾ താരതമ്യേന ഹൈഡ്രജനീകരണ താപത്തേക്കാൾ കുറവും ആണ്.
- കാർബോകാറ്റയോണുകളുടെ സ്ഥിരതയുടെ അടിസ്ഥാനത്തിൽ അവയെ അവരോഹണക്രമത്തിൽ താഴെ തന്നിരിക്കുന്നു. ത്രിതീയ കാർബോകാറ്റയോൺ > ദ്വിതീയ കാർബോകാറ്റയോൺ > പ്രാഥമിക കാർബോകാറ്റയോൺ > മീഥൈൽ കാറ്റയോൺ (CH3)3C+ > (CH3)2CH+ > (CH3)CH2+ > CH3+ [11]
അപൂരിത സംയുക്തങ്ങളിലെ അതിസംയുഗ്മന പ്രഭാവം[തിരുത്തുക]
ആദേശം വർദ്ധിക്കും തോറും കാർബൺ ആറ്റത്തിനിടയിലെ ദ്വിബന്ധനത്തിന്റെ സ്ഥിരത വർദ്ധിക്കുന്ന സ്വഭാവത്തിന്റെ കാരണമെന്ന രീതിയിൽ അതിസംയുഗ്മനത്തെ പ്രയോജനപ്പെടുത്താറുണ്ട്. അതിസംയുഗ്മനത്തെപ്പറ്റിയുടെ ആദ്യകാല പഠനങ്ങൾ ജോർജ് കിസ്റ്റിയോകോവ്സ്കിയുടെ ഗവേഷണ സംഘമാണ് നടത്തിയത്. 1937 ൽ പ്രസിദ്ധീകരിക്കപ്പെട്ട അവരുടെ ഗവേഷണ റിപ്പോർട്ട് അപൂരിതവും, ചാക്രികവുമായ സംയുക്തങ്ങളിലെ സങ്കലന രാസപ്രവർത്തനം അഥവാ അഡീഷൻ രാസപ്രവർത്തനത്തിലുള്ള ഊർജ്ജ വ്യതിയാനങ്ങളെ പറ്റിയുള്ള താപരാസിക പഠനങ്ങളെപ്പറ്റിയുള്ള പ്രാഥമികമായ പുരോഗമന റിപ്പോർട്ടായിരുന്നു. ക്വാണ്ടം രസതന്ത്ര കണക്കുകൂട്ടലുകൾ[12] മേൽ പ്രസ്താവിച്ച പ്രതിഭാസത്തെ വിശദീകരിക്കുന്നതിൽ അതിസംയുഗ്മനത്തിന് ഉള്ള പ്രാധാന്യത്തെ അംഗീകരിക്കുന്നു. അടുത്തായി സ്ഥിതിചെയ്യുന്ന C-H സിഗ്മ ബന്ധനത്തിൽ നിന്നുള്ള അടുത്തുള്ള π* പ്രതിബന്ധക ഓർബിറ്റിലേക്കുള്ള (Antibonding orbital) ഇലക്ട്രോൺ സാന്ദ്രതാ കൈമാറ്റമാണ് ഇവിടെ നടക്കുന്ന പ്രാധാന്യമർഹിക്കുന്ന പ്രക്രിയ. ഈ പ്രക്രിയയെ σC–H→π* എന്ന് സൂചിപ്പിക്കാം.
ആൽക്കീൻ ഏകകം അടങ്ങിയിട്ടുള്ള ചില സംയുക്തങ്ങളിൽ നടക്കുന്ന വാതകാവസ്ഥയിലെ രാസപ്രവർത്തനത്തിലെ ഹൈഡ്രജനീകരണതാപത്തിന്റെ ദത്തങ്ങൾ ശേഖരിക്കുന്നതായിരുന്നു കിസ്റ്റിയാകോവ്സ്കിയുടെ പരീക്ഷണങ്ങളിലെ ആദ്യ തലങ്ങളിലൊന്ന്. അവയിൽ ഏക-ആൽക്കൈൽ ആദേശിത (Mono alkyl substituted) ആൽക്കീനുകളെ ശ്രദ്ധിച്ചപ്പോൾ അതിലെ ആൽക്കൈൽ ഗ്രൂപ്പ് ശ്രദ്ധേയമാം വണ്ണം സംയുക്തത്തിന്റെ സ്ഥിരതയെ വർദ്ധിപ്പിച്ചതായി കണ്ടെത്തി. പക്ഷെ ആ ആൽക്കൈൽ ഗ്രൂപ്പുകൾക്ക് തീരെ ചെറുതോ- അല്ലാത്തതോ ആയ പ്രഭാവം ആണ് ഉണ്ടായിരുന്നത്.[13]
കിസ്റ്റിയോവ്സ്കിയുടെ മറ്റൊരു പ്രവൃത്തിയിൽ CH2=CH(CH2 )n-CH=CH2 (n=0,1,2) എന്നീ രൂപങ്ങളിൽ കാണപ്പെടുന്ന അപൂരിത സംയുക്തങ്ങളുടെ താരതമ്യം ആണ് ഉണ്ടായിരുന്നത്. ഈ പരീക്ഷണങ്ങൾ n ന്റെ മൂല്യം പൂജ്യം ആയിരിക്കുമ്പോൾ സംയുക്തത്തിൽ ഒരു സംയുഗ്മന പ്രഭാവം പ്രാബല്യത്തിൽ വരുന്നുവെന്നും അത് ΔH മൂല്യത്തെ 3.5 kcal എന്ന രീതിയിൽ കുറക്കുന്നുവെന്നും കണ്ടെത്തി. ഇത് എഥിലിൻ സംയുക്തത്തിൽ രണ്ട് ആൽക്കൈൽ ഗ്രൂപ്പുകളുടെ സങ്കലനത്തിന് അനുയോജ്യമാക്കുകയും ചെയ്യുന്നു. തുറന്ന ശ്രേണീ സംയുക്തങ്ങളിൽ (Open chain systems) ഉള്ള തന്മാത്രകളുടെ കൂട്ടിച്ചേർക്കലിൽ ഉൽസർജ്ജിതമാകുന്ന താപത്തിന്റെ അളവ് ഏറ്റവും കൂടുതൽ 1,4 എന്നീ സ്ഥാനങ്ങളിൽ കൂട്ടിച്ചേർക്കൽ (അഥവാ ആദേശം അല്ലെങ്കിൽ അഡീഷൻ) നടക്കുമ്പോഴാണെന്നും അദ്ദേഹം കണ്ടെത്തുകയുണ്ടായി. ഇത്തരം പരീക്ഷണങ്ങളിൽ ചാക്രിക സംയുക്തങ്ങളായിരുന്നു കൂടുതൽ സങ്കീർണ്ണത പുലർത്തിയിരുന്നത് എന്നു വേണം പറയാൻ. കാരണം അതിൽ തന്മാത്രയുടെ ശ്രേണിയെ അഥവാ സ്ട്രെയിനിനെ പരിഗണിക്കേണ്ടതായി വരുന്നു. അഞ്ചംഗ വളയങ്ങളുടെ (Five membered rings) സ്ട്രെയിൻ അപൂരണതോതിന്റെ അവനമനത്തിനനുസരിച്ച് കൂടുന്നു. ഈ ഫലം വളരെ അതിശയകരമായിരുന്നു. ഇതിന്റെ പര്യവേക്ഷണം പിന്നീട് ചാക്രിക ഘടനയുള്ള ആസിഡ് അൻഹൈഡ്രൈഡ്, ലാക്ടോൺ എന്നീ സംയുക്തങ്ങളിൽ നടത്തിയ പരീക്ഷണങ്ങളിലൂടെ നടത്തപ്പെട്ടിരുന്നു.മറ്റു അപൂരിത സംയുക്തങ്ങളെ അപേക്ഷിച്ച് രാസപരമായ പെരുമാറ്റത്തിലുടെ വ്യത്യസ്തതമൂലെ ചാക്രിക ഘടനയുള്ള ബെൻസീൻ, അവയുടെ വ്യുൽപ്പന്നങ്ങൾ എന്നിവയും ഇത്തരത്തിലും ഇദ്ദേഹം പഠനത്തിന് വിധേയമാക്കിയിരുന്നു.[14] കിസ്റ്റിയാകോവ്സ്കിയുടെ പരീക്ഷണം അപൂർണ്ണമായിരുന്നെങ്കിൽ കൂടി അതിസംയുഗ്മനത്തെപ്പറ്റിയും സംയുഗ്മന പ്രഭാവത്തെപ്പറ്റിയും ഉള്ള പ്രാഥമികവും, വഴിത്തിരിവേകുന്നതുമായ വിശകലനങ്ങളും റിപ്പോർട്ടുകളും ശാസ്ത്രലോകത്തിന് വളരെ സഹായകരമായിരുന്നു.
പ്രൊപ്പിലീനിലെ അതിസംയുഗ്മനം[തിരുത്തുക]
പ്രൊപ്പിലീൻ തന്മാത്രയിൽ മീഥൈൽ ഗ്രൂപ്പ് C=C ൽ π ബന്ധനത്താൽ ബന്ധിച്ചിട്ടുണ്ട്. ഇവിടെ ഏതെങ്കിലും മൂന്ന് C-H ബന്ധനങ്ങളിൽ ഒരു സിഗ്മ ബന്ധനം CH3 യിലെ π ഓർബിറ്റലുമായി അതിസംയുഗ്മനത്തിലേർപ്പെടുന്നു.
റെസോണെൻസ് ഘടനകൾക്കനുസൃതമായി (അനുരൂപീകരണ ഘടന) പ്രൊപ്പീനിൽ ചില വിഹിത രൂപങ്ങളിൽ ബന്ധനങ്ങളുടെ അസാന്നിദ്ധ്യം അനുഭവപ്പെടുന്നു. അതായത് ചില ഘടനകളിൽ H ആറ്റം ബന്ധനമുക്തമായി കാണപ്പെടുന്നു. അതിന് മേൽപ്പറഞ്ഞ കാർബണിനും ഹൈഡ്രജനും ഇടയിലെ സിഗ്മ ബന്ധനങ്ങൾ അതിസംയുഗ്മനത്തിൽ ഏർപ്പെടുന്നതാണ് കാരണം. എന്നിരുന്നാലും ഈ സംയുക്തത്തിൽ ഹൈഡ്രജൻ ആറ്റം സംയുക്തത്തിൽ നിന്നും ഒഴിവാക്കപ്പെട്ടു എന്നോ പുറത്തേക്ക് പോയെന്നോ അർത്ഥമാക്കേണ്ടതില്ല. ഇത്തരത്തിലുള്ള ബന്ധനരഹിത അനുരൂപീകരണ ഘടനകളുടെ അഥവാ റെസോണെൻസ് ഘടനകളുടെ രൂപീകരണത്തിന് അതിസംയുഗ്മനം കാരണമാകുന്നതുകൊണ്ട് ഈ പ്രതിഭാസത്തെ (അതിസംയുഗ്മനത്തെ) ബന്ധനമുക്ത അനുരൂപീകരണം അഥവാ ബന്ധനരഹിത അനുരൂപീകരണം (No bond resonance) എന്നു വിളിക്കുന്നു.
ഈതെയ്നിലെ പരിക്രമണ പ്രതിബന്ധം (റൊട്ടേഷണൽ ബാരിയർ)[തിരുത്തുക]
1930 കാലഘട്ടത്തിനു മുൻപേ തന്നെ (അതിസംയുഗ്മനം പ്രാവർത്തികമാക്കുന്നതിനും മുമ്പേ) ഈതെയ്ൻ തന്മാത്രയുടെ ഗ്രസിത സംരൂപണം അഥവാ എക്ലിപ്സ്ഡ് കൺഫോർമേഷൻ അതിന്റെ തന്നെ അന്തരിത സംരൂപണം അഥവാ സ്റ്റാഗേർഡ് കൺഫോർമേഷനേക്കാൾ സ്ഥിരതയുള്ളതാണെന്ന് കണ്ടെത്തിയിരുന്നു. എക്ലിപ്സ്ഡ്, സ്റ്റാഗേർഡ് സംരൂപണങ്ങളും ഊർജ്ജ പ്രതിബന്ധം (Energy barrier) ഏകദേശം 3 kcal ആണെന്ന് വിൽസൺ കണ്ടെത്തിയിരുന്നു. 2001 ൽ ഗുഡ്മാൻ എന്ന വ്യക്തി ഇത്തരത്തിലുള്ള സ്ഥിരതയെ വിശദീകരിക്കാൻ അതിസംയുഗ്മന ഇൻററാക്ഷൻ (Hyperconjugative interaction), പോളി അപവർജ്ജന തത്വം (Pauly Exclusion Principle) അനുസരിച്ചുള്ള വിനിമയ വികർഷണം അഥവാ എക്സ്ചേഞ്ച് റിപൾഷൻ, സ്ഥിതവൈദ്യുത ഇന്ററാക്ഷൻ അല്ലെങ്കിൽ കൂളോം ഇന്ററാക്ഷൻ എന്നീ മൂന്ന് പ്രാഥമികവും ഭൌതികവുമായ ഘടകങ്ങൾക്ക് ഊന്നൽ നൽകി. അദ്ദേഹം വിനിമയ വികർഷണങ്ങളെ ഒഴിവാക്കിയ പരമ്പരാഗതമായ ഈതെയ്ൻ തന്മാത്രയും പരികൽപ്പിത ഇതെയ്ൻ തന്മാത്രയും തമ്മിലുള്ള താരതമ്യത്തെ അടിസ്ഥാനമാക്കി ടോർഷണീയ കോണും ഓരോ തന്മാത്രയിലും ഉള്ള ഊർജ്ജവും അതത് അക്ഷത്തിൽ ഉൾക്കൊള്ളിച്ച് പൊട്ടൻഷ്യൽ വക്രങ്ങൾ (Potential curve) നിർമ്മിക്കുകയുണ്ടായി. ഈ വക്രങ്ങളുടെ വിശകലനം വഴി അന്തരിത സംരൂപണത്തിന് തന്മാത്രയുടെ ഉള്ളിൽ സംയുതമായ സ്ഥിതവൈദ്യുത വികർഷണത്തിന്റെ അളവുമായി യാതൊരു ബന്ധവുമില്ല എന്ന് മനസ്സിലാക്കാൻ സാധിച്ചു. അതിനാൽ തന്നെ കൂളോം ബലങ്ങൾ സ്റ്റാഗേർഡ് കൺഫോർമേഷനുകളെ വ്യക്തമാക്കാൻ സാധിക്കുന്നില്ല എന്ന് കണ്ടെത്തി.

അതുപോലെ തന്നെ ഗുഡ്മാൻ വിസിനൽ (രണ്ട് മീഥൈൽ ഗ്രൂപ്പുകൾക്കിടയിൽ) ജെമിനൽ (ഒരു മീഥൈൽ ഗ്രൂപ്പുകളിലെ ആറ്റങ്ങൾക്കിടയിൽ) എന്നിവയ്ക്കിടയിലെ ഇന്ററാക്ഷൻ അതിസംയുഗ്മനത്തിൽ വഹിക്കുന്ന പങ്ക് വ്യക്തമാക്കാൻ സഹായിക്കുന്ന പഠനങ്ങളും നടത്തിയിരുന്നു. വ്യത്യസ്ത പരീക്ഷണങ്ങളിൽ ജെമിനൽ, വിസിനൽ ഇന്ററാക്ഷനുകൾ എടുത്തുമാറ്റുകയും ഓരോ ഇന്ററാക്ഷനിലും കൂടുതൽ സ്ഥിരതയുള്ള കൺഫോമറുകളെ സംശ്ലേഷണം ചെയ്തെടുക്കുകയും ചെയ്തു.
ഈ പരീക്ഷണങ്ങളിൽ നിന്ന് തന്നെ അതിസംയുഗ്മനം ചാർജ്ജുകളുടെ വിസ്ഥാപനം (Dislocation) നടത്തുന്നുവെന്നും തൽഫലമായി തന്മാത്ര സ്ഥിരതയുള്ളതാകുന്നുവെന്നും മനസ്സിലാക്കാം. അതുപോലെ തന്നെ വിസിനൽ സംയുഗ്മനമാണ് തന്മാത്രയെ സ്റ്റോഗേർഡ് കൺഫർമേഷനിൽ സൂക്ഷിക്കുന്നത് എന്നും മനസ്സിലാക്കാൻ സാധിച്ചു. ഈ പരീക്ഷണമാണ് ഈതെയ്ൻ തന്മാത്രയുടെ സ്റ്റാഗേർഡ് സംരൂപണത്തിന് സ്ഥിരതയുടെ അടിസ്ഥാനത്തിൽ കൂടുതൽ സ്വീകാര്യത നേടിക്കൊടുത്തത്.
അതിസംയുഗ്മനത്തിന് കുറെ അധികം പ്രതിഭാസങ്ങളെ വിശദീകരിക്കാൻ സാധിക്കും എന്നതാണ് സത്യം. അതിൽ പ്രാധാന്യമർഹിക്കുന്ന ഒന്ന് തന്നെയാണ് ഈതെയ്നിലെ പരിക്രമണ പ്രതിബന്ധം അഥവാ റൊട്ടേഷണൺ ബാരിയർ. പാരിമാണിമായി തന്മാത്രാ ഓർബിറ്റൽ സിദ്ധാന്തത്തിന്റെ (Molecular Orbital Theory, MOT) അടിസ്ഥാനത്തിൽ വിശകലനം ചെയ്യുമ്പോൾ ഈ തന്മാത്രയിലെ 2-ഓർബിറ്റൽ-4-ഇലക്ട്രോൺ വികർഷണം (സ്റ്റെറിക് പ്രഭാവത്തിന് അടിസ്ഥാനമായ) അതിസംയുഗ്മനത്തിനുമേൽ പ്രകടമാണെന്ന് മനസ്സിലാക്കാം. വാലൻസ് ബോണ്ട് സിദ്ധാന്തവും (സംയോജനാ ബന്ധന സിദ്ധാന്തം) ഇതിനെ വിശദീകരിക്കുന്നുണ്ട്.
അവലംബം[തിരുത്തുക]
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hyperconjugation".
- ↑ John McMurry. Organic chemistry, 2nd edition. ISBN 0-534-07968-7
- ↑ Alabugin, I.V.; Gilmore, K.; Peterson, P. (2011). "Hyperconjugation". WIREs Comput Mol Sci. 1: 109–141. doi:10.1002/wcms.6.
- ↑ Alabugin, I. V. (2016) Remote Stereoelectronic Effects, in Stereoelectronic Effects: A Bridge Between Structure and Reactivity, John Wiley & Sons, Ltd, Chichester, UK. doi:10.1002/9781118906378.ch8
- ↑ Madan, R.L. (2013). "4.14: Hyperconjugation or No-bond Resonance". Organic Chemistry. Tata McGraw–Hill. ISBN 9789332901070.
- ↑ Deasy, C.L. (1945). "Hyperconjugation". Chem. Rev. 36 (2): 145–155. doi:10.1021/cr60114a001.
- ↑ Pophristic, V.; Goodman, L. (2001). "Hyperconjugation not steric repulsion leads to the staggered structure of ethane". Nature. 411 (6837): 565–8. doi:10.1038/35079036. PMID 11385566.
- ↑ Frank Weinhold (2001). "Chemistry. A new twist on molecular shape". Nature. 411 (6837): 539–41. doi:10.1038/35079225. PMID 11385553.
- ↑ Deasy, C.L. (1945). "Hyperconjugation". Chem. Rev. 36 (2): 145–155. doi:10.1021/cr60114a001.
- ↑ Schmeising, H.N.; et al. (1959). "A Re-Evaluation of Conjugation and Hyperconjugation: The Effects of Changes in Hybridisation on Carbon Bonds". Tetrahedron. 5 (2–3): 166–178. doi:10.1016/0040-4020(59)80102-2.
- ↑ Alabugin, Igor V.; Bresch, Stefan; dos Passos Gomes, Gabriel (2014). "Orbital hybridization: a key electronic factor in control of structure and reactivity". Journal of Physical Organic Chemistry. 28: 147–162. doi:10.1002/poc.3382.
- ↑ Braida, Benoit; Prana, Vinca; Hiberty, Philippe C. (2009). "The Physical Origin of Saytzeff's Rule". Angewandte Chemie International Edition. 48 (31): 5724–5728. doi:10.1002/anie.200901923. ISSN 1521-3773. PMID 19562814.
- ↑ Kistiakowsky, G. B.; et al. (1937). "Energy Changes Involved in the Addition Reactions of Unsaturated Hydrocarbons". Chem. Rev. 20 (2): 181–194. doi:10.1021/cr60066a002.
- ↑ Kistiakowsky, G. B.; et al. (1937). "Energy Changes Involved in the Addition Reactions of Unsaturated Hydrocarbons". Chem. Rev. 20 (2): 181–194. doi:10.1021/cr60066a002.
