"ന്യൂട്രോൺ" എന്ന താളിന്റെ പതിപ്പുകൾ തമ്മിലുള്ള വ്യത്യാസം
(ചെ.) യന്ത്രം ചേര്ക്കുന്നു: hy:Նեյտրոն |
(ചെ.) പുതിയ ചിൽ ... |
||
| വരി 1: | വരി 1: | ||
{{prettyurl|Neutron}} |
{{prettyurl|Neutron}} |
||
[[ചിത്രം:Quark structure neutron.svg|thumb|right|250px|ന്യൂട്രോണിന്റെ [[ |
[[ചിത്രം:Quark structure neutron.svg|thumb|right|250px|ന്യൂട്രോണിന്റെ [[ക്വാർക്ക്]] രൂപം]] |
||
[[അണുകേന്ദ്രം|അണുകേന്ദ്രത്തിലടങ്ങിയിരിക്കുന്ന]] |
[[അണുകേന്ദ്രം|അണുകേന്ദ്രത്തിലടങ്ങിയിരിക്കുന്ന]] ചാർജില്ലാത്ത ഒരു കണമാണ് '''ന്യൂട്രോൺ'''. |
||
ന്യൂട്രോണിന് |
ന്യൂട്രോണിന് വൈദ്യുതചാർജില്ല. [[പ്രോട്ടോൺ|പ്രോട്ടോണിനേക്കാൾ]] അല്പം [[പിണ്ഡം]] കൂടുതലാണിതിന്. ചില മൂലകങ്ങളുടെ അണുക്കളിൽ ന്യൂട്രോണുകളുടെ എണ്ണത്തിന് ചെറിയ മാറ്റമുണ്ടായിരിക്കും. എങ്കിലും ആ മൂലകത്തിന്റെ രാസഗുണങ്ങൾക്ക് മാറ്റമൊന്നുമുണ്ടാകില്ല. ഇങ്ങനെ വ്യത്യസ്ത എണ്ണം ന്യൂട്രോണുകളുള്ള ഒരേ ആറ്റത്തിന്റെ വിവിധ രൂപങ്ങളെയാണ് [[ഐസോടോപ്പ്]] എന്നു പറയുന്നത്. |
||
ന്യൂട്രോണുകൾ ചാർജ്ജു രഹിത കണികകളാണ്. ഇവയെ വിഭജിച്ചാൽ ക്വാർക്കുകൾ ലഭിക്കുന്നു. ആറ്റമിക ഭാരം നിർണയിക്കുന്നതിനാൽ രാസപ്രക്രിയയിൽ പങ്കാളിയാവുന്നു. പ്രോട്ടോണുകളേക്കാൾ ഒരൽപം കനംകൂടിയ കണികകളാണിവ. അതായത് ഒരു ദശാംശത്തിന്റെ 26 പൂജ്യങ്ങൾക്ക് ശേഷം വരുന്ന 16749 അത്രയും കിലോഗ്രാം. ഇത് ഇലക്ട്രോണിന്റെ 1838 മടങ്ങ് വലുതാണ്. എന്നാൽ ആറ്റമിക സംഖ്യയിൽ ഇവയ്ക്ക് പങ്കാളിത്തമില്ല. രണ്ട് ഡൌൺ ക്വാർക്കുകളും ഒരു അപ്പ് ക്വാർക്കും കൊണ്ട് നിർമിച്ചിരിക്കുന്നതിനാൽ മൊത്തം ചാർജ്ജ് പൂജ്യമായി നിലനിൽക്കുന്നു. ഐസോടോപ്പുകളെന്നറിയപ്പെടുന്ന മൂലകങ്ങളുടെ സഹോദരങ്ങളെ നിർമിക്കുന്നത് ന്യൂട്രോണുകളുടെ വ്യത്യാസത്തിലാണ്. ഹൈഡ്രജന്റെ ആറ്റത്തിനോട് ഒരു ന്യൂട്രോൺ ചേർന്നാൽ അതു ഡ്യൂട്ടേരിയവും രണ്ടെണ്ണം ചേർന്നാൽ ട്രിറ്റിയവുമായി മാറുന്നു. പിൺഡമുള്ളതിനാൽ എല്ലാ ബലങ്ങളും ഇതിനെ സ്വാധീനിക്കുന്നു. വിദ്യുത് ബലമില്ലെങ്കിലും കാന്തിക ബലം ഒരൽപം കാണിക്കുന്നതിനാൽ വിദ്യുത്കാന്തികബലത്തിന്റെ സ്വാധീനവും ഇതിനുണ്ട്. സ്വതന്ത്രമായ ഒരൂ ന്യൂട്രോണിന്റെ ആയുസ്സ് 15 മിനിട്ടാണ്. എന്നാൽ ആറ്റത്തിലുള്ള ന്യൂട്രോണുകൾ അത്ര എളുപ്പം നശിക്കുന്നില്ല. ഒരുപാടു ന്യൂട്രോണുകളുള്ള ആറ്റങ്ങൾ ചില വ്യതിയാനങ്ങൾ കാണിക്കാറുണ്ട്. ഉദാഹരണത്തിന് കാർബൺ 14 എന്ന മൂലകത്തിൽ 8 ന്യൂട്രോണുകളും 6 പ്രോട്ടോണുകളും അടങ്ങിയിരിക്കുന്നു. ഇവ ഇതേപോലെ 11460 വർഷം നിലനിൽക്കും. ഇത് കണക്കാക്കിയാണ് സി-16 പോലുള്ള ടെസ്റ്റുകൾ വികസിപ്പിക്കുന്നത്. അത്രയും കാലം കഴിഞ്ഞാൽ അവ റേഡിയോ ആക്ടീവത എന്ന സ്വഭാവം പ്രകടിപ്പിക്കും. അതായത് മറ്റൊന്നായി മാറും. |
|||
രണ്ട് അടുത്തടുത്ത |
രണ്ട് അടുത്തടുത്ത പ്രോടോണുകൾ പരസ്പരം വികർഷിക്കുമ്പോൾ അവയെ പിടിച്ചു നിർത്തുക എന്ന ജോലിയാണ് ന്യൂട്രോണിന്. ഈ വികർഷണത്തിന്റെ ശക്തിയാവട്ടെ വിദുത്ഛക്തിയുടെ 100 ദശലക്ഷം മടങ്ങ് അധികം വരും. ഇതിനാലാണ് ആറ്റം ബോംബുകളുടെ ശക്തി അപാരമാവുന്നത്. ന്യൂട്രോൺ കൊണ്ട് ഒരു ആറ്റത്തെ പിളർക്കുമ്പോൾ അപരിമേയമായ ഈ ന്യൂക്ലിയർ ഊർജ്ജം ഉത്സർജ്ജിക്കപ്പെടുന്നു. |
||
== അവലംബം == |
== അവലംബം == |
||
* ഡോർലിങ് കിൻഡർസ്ലെയ് - കൺസൈസ് എൻസൈക്ലോപീഡിയ സയൻസ് - ലേഖകൻ: നീൽ ആർഡ്ലി |
|||
* ഡോര്ലിങ് കിന്ഡര്സ്ലെയ് - കണ്സൈസ് എന്സൈക്ലോപീഡിയ സയന്സ് - ലേഖകന്: നീല് ആര്ഡ്ലി |
|||
{{particles}} |
{{particles}} |
||
{{Physics-stub|Neutron}} |
{{Physics-stub|Neutron}} |
||
[[വിഭാഗം:ഭൗതികശാസ്ത്രത്തിന്റെ |
[[വിഭാഗം:ഭൗതികശാസ്ത്രത്തിന്റെ അടിസ്ഥാനതത്ത്വങ്ങൾ]] |
||
[[വിഭാഗം: |
[[വിഭാഗം:ന്യൂട്രോൺ]] |
||
{{Link FA|lmo}} |
{{Link FA|lmo}} |
||
06:41, 11 ഏപ്രിൽ 2010-നു നിലവിലുണ്ടായിരുന്ന രൂപം
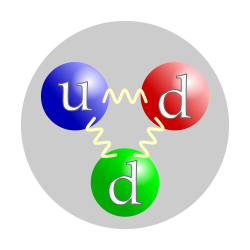
അണുകേന്ദ്രത്തിലടങ്ങിയിരിക്കുന്ന ചാർജില്ലാത്ത ഒരു കണമാണ് ന്യൂട്രോൺ.
ന്യൂട്രോണിന് വൈദ്യുതചാർജില്ല. പ്രോട്ടോണിനേക്കാൾ അല്പം പിണ്ഡം കൂടുതലാണിതിന്. ചില മൂലകങ്ങളുടെ അണുക്കളിൽ ന്യൂട്രോണുകളുടെ എണ്ണത്തിന് ചെറിയ മാറ്റമുണ്ടായിരിക്കും. എങ്കിലും ആ മൂലകത്തിന്റെ രാസഗുണങ്ങൾക്ക് മാറ്റമൊന്നുമുണ്ടാകില്ല. ഇങ്ങനെ വ്യത്യസ്ത എണ്ണം ന്യൂട്രോണുകളുള്ള ഒരേ ആറ്റത്തിന്റെ വിവിധ രൂപങ്ങളെയാണ് ഐസോടോപ്പ് എന്നു പറയുന്നത്.
ന്യൂട്രോണുകൾ ചാർജ്ജു രഹിത കണികകളാണ്. ഇവയെ വിഭജിച്ചാൽ ക്വാർക്കുകൾ ലഭിക്കുന്നു. ആറ്റമിക ഭാരം നിർണയിക്കുന്നതിനാൽ രാസപ്രക്രിയയിൽ പങ്കാളിയാവുന്നു. പ്രോട്ടോണുകളേക്കാൾ ഒരൽപം കനംകൂടിയ കണികകളാണിവ. അതായത് ഒരു ദശാംശത്തിന്റെ 26 പൂജ്യങ്ങൾക്ക് ശേഷം വരുന്ന 16749 അത്രയും കിലോഗ്രാം. ഇത് ഇലക്ട്രോണിന്റെ 1838 മടങ്ങ് വലുതാണ്. എന്നാൽ ആറ്റമിക സംഖ്യയിൽ ഇവയ്ക്ക് പങ്കാളിത്തമില്ല. രണ്ട് ഡൌൺ ക്വാർക്കുകളും ഒരു അപ്പ് ക്വാർക്കും കൊണ്ട് നിർമിച്ചിരിക്കുന്നതിനാൽ മൊത്തം ചാർജ്ജ് പൂജ്യമായി നിലനിൽക്കുന്നു. ഐസോടോപ്പുകളെന്നറിയപ്പെടുന്ന മൂലകങ്ങളുടെ സഹോദരങ്ങളെ നിർമിക്കുന്നത് ന്യൂട്രോണുകളുടെ വ്യത്യാസത്തിലാണ്. ഹൈഡ്രജന്റെ ആറ്റത്തിനോട് ഒരു ന്യൂട്രോൺ ചേർന്നാൽ അതു ഡ്യൂട്ടേരിയവും രണ്ടെണ്ണം ചേർന്നാൽ ട്രിറ്റിയവുമായി മാറുന്നു. പിൺഡമുള്ളതിനാൽ എല്ലാ ബലങ്ങളും ഇതിനെ സ്വാധീനിക്കുന്നു. വിദ്യുത് ബലമില്ലെങ്കിലും കാന്തിക ബലം ഒരൽപം കാണിക്കുന്നതിനാൽ വിദ്യുത്കാന്തികബലത്തിന്റെ സ്വാധീനവും ഇതിനുണ്ട്. സ്വതന്ത്രമായ ഒരൂ ന്യൂട്രോണിന്റെ ആയുസ്സ് 15 മിനിട്ടാണ്. എന്നാൽ ആറ്റത്തിലുള്ള ന്യൂട്രോണുകൾ അത്ര എളുപ്പം നശിക്കുന്നില്ല. ഒരുപാടു ന്യൂട്രോണുകളുള്ള ആറ്റങ്ങൾ ചില വ്യതിയാനങ്ങൾ കാണിക്കാറുണ്ട്. ഉദാഹരണത്തിന് കാർബൺ 14 എന്ന മൂലകത്തിൽ 8 ന്യൂട്രോണുകളും 6 പ്രോട്ടോണുകളും അടങ്ങിയിരിക്കുന്നു. ഇവ ഇതേപോലെ 11460 വർഷം നിലനിൽക്കും. ഇത് കണക്കാക്കിയാണ് സി-16 പോലുള്ള ടെസ്റ്റുകൾ വികസിപ്പിക്കുന്നത്. അത്രയും കാലം കഴിഞ്ഞാൽ അവ റേഡിയോ ആക്ടീവത എന്ന സ്വഭാവം പ്രകടിപ്പിക്കും. അതായത് മറ്റൊന്നായി മാറും.
രണ്ട് അടുത്തടുത്ത പ്രോടോണുകൾ പരസ്പരം വികർഷിക്കുമ്പോൾ അവയെ പിടിച്ചു നിർത്തുക എന്ന ജോലിയാണ് ന്യൂട്രോണിന്. ഈ വികർഷണത്തിന്റെ ശക്തിയാവട്ടെ വിദുത്ഛക്തിയുടെ 100 ദശലക്ഷം മടങ്ങ് അധികം വരും. ഇതിനാലാണ് ആറ്റം ബോംബുകളുടെ ശക്തി അപാരമാവുന്നത്. ന്യൂട്രോൺ കൊണ്ട് ഒരു ആറ്റത്തെ പിളർക്കുമ്പോൾ അപരിമേയമായ ഈ ന്യൂക്ലിയർ ഊർജ്ജം ഉത്സർജ്ജിക്കപ്പെടുന്നു.
അവലംബം
- ഡോർലിങ് കിൻഡർസ്ലെയ് - കൺസൈസ് എൻസൈക്ലോപീഡിയ സയൻസ് - ലേഖകൻ: നീൽ ആർഡ്ലി

