സിൽവർ അസൈഡ്

| |
| Identifiers | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.034.173 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | colorless solid |
| സാന്ദ്രത | 4.42 g/cm3, solid |
| ദ്രവണാങ്കം | |
| ക്വഥനാങ്കം | |
| Solubility in other solvents | 2.0×10−8 g/L |
| Structure | |
| Orthorhombic oI16[1] | |
| Ibam, No 72 | |
| Hazards | |
| Main hazards | Very toxic, explosive |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
AgN3 എന്ന രാസസൂത്രത്തോടു കൂടിയ രാസ സംയുക്തമാണ് സിൽവർ അസൈഡ്. നിറമില്ലാത്ത ഈ ഖരപദാർത്ഥം, അറിയപ്പെടുന്ന ഒരു സ്ഫോടകവസ്തുവാണ്.
ഘടനയും രസതന്ത്രവും[തിരുത്തുക]
സിൽവർ നൈട്രേറ്റിന്റെ ജലീയ ലായനി സോഡിയം അസൈഡ് ജലീയ ലായനിയുമായി പ്രവർത്തിപ്പിച്ച് സിൽവർ അസൈഡ് തയ്യാറാക്കാം. [2] സിൽവർ അസൈഡ് വെളുത്ത ഖരരൂപത്തിൽ ലഭിക്കുന്നു. ഇതോടൊപ്പം സോഡിയം നൈട്രേറ്റ് ലായനിയും ഉണ്ടാകുന്നു.
- AgNO
3 (aq) + NaN
3 (aq) → AgN
3 (s) + NaNO
3 (aq)
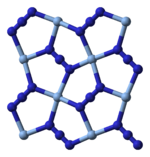
സിൽവർ അസൈഡ് ഒരൊറ്റ തന്മാത്രയായിട്ടല്ല മറിച്ച് അനേകം തന്മാത്രകൾ സമചതുരാകൃതിയിൽ നിരപ്പായി കണ്ണിചേർക്കപ്പെട്ട പാളികളായിട്ടാണെന്ന് എക്സ്-റേ ക്രിസ്റ്റലോഗ്രാഫി കാണിക്കുന്നു. ഈ സമചതുരങ്ങളുടെ ഒത്തനടുക്ക് അയോണും(ഇളം നീല) നാലു മൂലക്കും ഓരോ അസൈഡ് ലിഗാൻഡുമാണ്(കടും നീല). ഈ ഓരോ അസൈഡ് ലിഗാൻഡിന്റേയും മറ്റേ അറ്റം മറ്റൊരു ജോടി Ag+ അയോണുകളുമായി ബന്ധിപ്പിച്ചിരിക്കുന്നു. ഈ ഘടനയിൽ, ദ്വിമാന AgN3 പാളികൾ ഒന്നിനു മുകളിൽ മറ്റൊന്നായി അടുക്കിയിരിക്കുന്നു, ഈ പാളികൾക്കിടയിൽ ദുർബലമായ Ag-N ബോണ്ടുകൾ അടങ്ങിയിരിക്കുന്നു.[3] .
 |
 |
 |
 |
3 </br> N− 3 |
അതിന്റെ സ്വഭാവ സവിശേഷതയിൽ, ഖരപദാർത്ഥം സ്ഫോടനാത്മകമായി വിഘടിച്ച് നൈട്രജൻ വാതകം പുറപ്പെടുവിക്കുന്നു:
- 2 AgN
3 (s) → 3 N
2 (g) + 2 Ag (s)
ഈ വിഘടനത്തിന്റെ ആദ്യ ഘട്ടം സ്വതന്ത്ര ഇലക്ട്രോണുകളുടെയും അസൈഡ് റാഡിക്കലുകളുടെയും ഉത്പാദനമാണ്. അർദ്ധചാലക ഓക്സൈഡുകൾ ചേർത്ത് പ്രതിപ്രവർത്തന നിരക്ക് വർദ്ധിക്കാം. [4] ശുദ്ധമായ സിൽവർ അസൈഡ് 340 ° C ൽ പൊട്ടിത്തെറിക്കുന്നു , എന്നാൽ മാലിന്യങ്ങളുടെ സാന്നിധ്യം ഇത് 270 ° C ആയി കുറയ്ക്കുന്നു. [5] ഈ പ്രക്രിയക്ക് ലെഡ് അസൈഡിന്റെ വിഘടനത്തേക്കാൾ കുറഞ്ഞ ആക്റ്റിവേഷൻ എനർജിയും പ്രകോപനസമയവും മാത്രമേ ആവശ്യമുള്ളു. [6]
സുരക്ഷ[തിരുത്തുക]
മിക്ക ഹെവി മെറ്റൽ അസൈഡുകളെയും പോലെ AgN3 അപകടകരമായ ഒരു സ്ഫോടകവസ്തുവാണ് . അൾട്രാവയലറ്റ് വെളിച്ചമേൽക്കുന്നതിലൂടെയോ ആഘാതം മൂലമോ വിഘടനം ആരംഭിക്കാം. [2] AgN
3 ചോർച്ച സംഭവിച്ചാൽ, ഇതിനെ നശിപ്പിക്കാൻ സെറിക് അമോണിയം നൈട്രേറ്റ് ഒരു ഓക്സീകാരിയായി ഉപയോഗിക്കുന്നു. [5]
ഇതും കാണുക[തിരുത്തുക]
അവലംബം[തിരുത്തുക]
- ↑ Marr H.E. III.; Stanford R.H. Jr. (1962). "The unit-cell dimensions of silver azide". Acta Crystallographica. 15 (12): 1313–1314. doi:10.1107/S0365110X62003497.
- ↑ 2.0 2.1 Robert Matyas, Jiri Pachman (2013). Primary Explosives (1st ed.). Springer. p. 93. ISBN 978-3-642-28435-9.
- ↑ Schmidt, C. L. Dinnebier, R.; Wedig, U.; Jansen, M. (2007). "Crystal Structure and Chemical Bonding of the High-Temperature Phase of AgN3". Inorganic Chemistry. 46 (3): 907–916. doi:10.1021/ic061963n. PMID 17257034.
{{cite journal}}: Unknown parameter|lastauthoramp=ignored (|name-list-style=suggested) (help)CS1 maint: multiple names: authors list (link) - ↑ Andrew Knox Galwey; Michael E. Brown (1999). Thermal decomposition of ionic solids (vol.86 of Studies in physical and theoretical chemistry. Elsevier. p. 335. ISBN 978-0-444-82437-0.
- ↑ 5.0 5.1 Margaret-Ann Armour (2003). Hazardous laboratory chemicals disposal guide, Environmental Chemistry and Toxicology (3rd ed.). CRC Press. p. 452. ISBN 978-1-56670-567-7.
- ↑ Jehuda Yinon; Shmuel Zitrin (1996). Modern Methods and Applications in Analysis of Explosives. John Wiley and Sons. pp. 15–16. ISBN 978-0-471-96562-6.

