രാസ ധ്രുവത
രസതന്ത്രത്തിൽ, രാസധ്രുവത എന്നത് ഒരു തന്മാത്രയിൽ മൊത്തമായോ അതിന്റെ രാസ ഗ്രൂപ്പുകളിലോ പ്രകടമാകുന്ന വൈദ്യുത ചാർജിന്റെ ചെറിയ തോതിലുള്ള വിഭജനമാണ്. ലളിതമായി പറഞ്ഞാൽ, ഒരു തന്മാത്രയിൽ അടങ്ങിയ ആറ്റങ്ങളുടെ ഇലക്ട്രോ നെഗറ്റിവിറ്റി വ്യത്യസ്തമായാൽ അവ തമ്മിൽ ബന്ധപ്പെടുമ്പോൾ ഇലക്ട്രോണുകൾ തുല്യമായി പങ്കു വെക്കപ്പെടുന്നില്ല[1]. ഈ ഏറ്റക്കുറച്ചിൽ ആണ് രാസധ്രുവതയുടെ അടിസ്ഥാനം. ഇത്തരം ബോണ്ടുകളെ പോളാർ ബോണ്ട് എന്നും തന്മാത്രയെ ഡൈപോൾ എന്നും വിശേഷിപ്പിക്കുന്നു.[2] [3] സാഹചര്യങ്ങൾക്കനുസരിച്ച് രാസധ്രുവത സ്ഥായിയോ താത്കാലികമോ ആകാം.
ഒരു തന്മാത്രയിൽ ഒന്നിലധികം പോളാർ ബോണ്ടുകൾ ഉണ്ടാകാം. എന്നിരിക്കിലും തന്മാത്രയുടെ ഘടനക്ക് ത്രിമാനതലത്തിൽ സമമിതി ( Symmetry) ഇല്ലെങ്കിൽ മാത്രമെ ധ്രുവത പ്രകടമാകൂ. കാരണം പോളാർ ബോണ്ടുകൾ വിപരീത ദിശകളിലാണെങ്കിൽ രാസധ്രുവത പരസ്പരം റദ്ദാക്കപ്പെടുന്നു. ധ്രുവ തന്മാത്രകൾ ഇന്റർമോളികുലാർ ശക്തികളിലൂടെയും ഹൈഡ്രജൻ ബോണ്ടുകളിലൂടെയും പരസ്പരം സംവദിക്കുന്നു. പ്രതലബലം ( Surface Tension) ), ലേയത്വം (Solubility), ദ്രവണാങ്കം ( Melting Point) ക്വഥനാങ്കം (Boiling Point) എന്നിവയുൾപ്പെടെ നിരവധി ഭൗതിക ഗുണങ്ങൾക്ക് ധ്രുവീകരണം അടിവരയിടുന്നു.
ബന്ധനങ്ങളുടെ രാസധ്രുവത[തിരുത്തുക]

എല്ലാ ആറ്റങ്ങളും ഒരേ ശക്തിയിൽ ഇലക്ട്രോണുകളെ ആകർഷിക്കുന്നില്ല. ഒരു ആറ്റത്തിന് ഇലക്ട്രോണുകളോടുള്ള ആകർഷണശക്തിയുടെ അളവാണ് അതിന്റെ ഇലക്ട്രോനെഗറ്റിവിറ്റി. ക്ഷാര ലോഹങ്ങൾ, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങൾ തുടങ്ങിയവക്ക് താഴ്ന്ന ഇലക്ട്രോനെഗറ്റിവിറ്റി ആണുള്ളത്. മറിച്ച് - ഫ്ലൂറിൻ, ഓക്സിജൻ, നൈട്രജൻ എന്നിവ ഉയർന്ന ഇലക്ട്രോനെഗറ്റീവിറ്റിയുള്ള ആറ്റങ്ങളാണ്[1] [4].
താരതമ്യേന സമാനമായ ഇലക്ട്രോനെഗറ്റിവിറ്റിയുള്ള ആറ്റങ്ങൾ ബന്ധപ്പെടുമ്പോൾ ഇലക്ട്രോണുകൾ തുല്യമായി പങ്കിടപ്പെടുന്നു. എന്നാൽ ബന്ധപ്പെടുന്ന ആറ്റങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റി വളരെ വ്യത്യസ്തമാണെങ്കിൽ അത് ഇലക്ട്രോണുകളുടെ അസമമായ പങ്കിടലിലേക്ക് നയിക്കുന്നു: കാരണം ഇലക്ട്രോണുകൾ ഉയർന്ന ഇലക്ട്രോനെഗറ്റിവിറ്റിയുള്ള ആറ്റത്തോട് കൂടുതൽ ആകർഷിക്കപ്പെടും. അങ്ങനെ ചെറിയ അളവിൽ പോസിറ്റീവ്, നെഗറ്റീവ് ഇലക്ട്രിക് ചാർജുകൾ വേർതിരിക്കപ്പെട്ട് ഒരു ഇലക്ട്രിക് ഡൈപോൾ രൂപപ്പെടുന്നു. അത്തരം ദ്വിധ്രുവങ്ങളിൽ(ഡൈപോൾ) വേർതിരിക്കപ്പെട്ട ചാർജിന്റെ അളവ് സാധാരണയായി അടിസ്ഥാന ചാർജിനേക്കാൾ ചെറുതായതിനാൽ, അവയെ ഭാഗിക ചാർജുകൾ എന്ന് വിളിക്കുന്നു, അവയെ δ+ (ഡെൽറ്റ പ്ലസ്), δ− (ഡെൽറ്റ മൈനസ്) എന്ന് സൂചിപ്പിക്കുന്നു. 1926 ൽ സർ ക്രിസ്റ്റഫർ ഇൻഗോൾഡും ഡോ. എഡിത്ത് ഹിൽഡ (അഷർവുഡ്) ഇൻഗോൾഡും ചേർന്നാണ് ഈ ചിഹ്നങ്ങൾ അവതരിപ്പിച്ചത്. വേർതിരിക്കപ്പെട്ട ചാർജിന്റെ അളവും ചാർജുകൾ തമ്മിലുള്ള ദൂരവും ഗുണിച്ചുകൊണ്ടാണ് ഡൈപോൾ മോമെൻറ് കണക്കാക്കുന്നത്. ഇത് രാസധ്രുവതയുടെ അളവും ദിശയും സൂചിപ്പിക്കുന്നു. അതായത് ഡൈപോൾ മോമെൻറ് ഒരു വെക്റ്റർ ഗുണമാണ്. തന്മാത്രകൾക്കുള്ളിലെ ഈ ദ്വിധ്രുവങ്ങൾക്ക് മറ്റ് തന്മാത്രകളിലെ ദ്വിധ്രുവങ്ങളുമായി ഇടപഴകാൻ കഴിയും, ഇത് ദ്വിധ്രുവ-ദ്വിധ്രുവ സമ്പർക്കം തന്മാത്രകൾക്കിടയിൽ ആകർഷണ-വികർഷണ ശക്തികൾ സൃഷ്ടിക്കുന്നു.
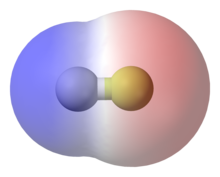
തരംതിരിക്കൽ[തിരുത്തുക]
തീരെ ധ്രുവതയില്ലാത്തതും ( totally nonpolar) ) പൂർണമായും ധ്രുവീയവും( Fully polar ) ആയ രണ്ട് തരം ബോണ്ടുകൾക്കിടയിലാണ് പോളാർ ബോണ്ടുകളുടെ സ്ഥാനം[5]. ബന്ധപ്പെടുന്ന ആറ്റങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റികൾ സമാനമാകുമ്പോൾ അഥവാ വ്യത്യാസം ഏതാണ്ട് പൂജ്യത്തോടടുത്ത് നിൽക്കുമ്പോൾ ഒട്ടും ധ്രുവീയമല്ലാത്ത ബോണ്ട് രൂപപ്പെടുന്നു. പൂർണമായും ധ്രുവീയമായ ബോണ്ടിനെ കൂടുതൽ കൃത്യമായി അയോണിക് ബോണ്ട് എന്ന് വിളിക്കുന്നു. ബന്ധപ്പെടുന്ന ആറ്റങ്ങളുടെ ഇലക്ട്രോനെഗറ്റീവിറ്റികൾ തമ്മിൽ ഭീമമായ വ്യത്യാസം ഉണ്ടെങ്കിൽ ഇലക്ട്രോൺ മുഴുവനായും കൂടുതൽ ഇലക്ട്രോനെഗറ്റിവിറ്റിയുള്ള ആറ്റത്തിലേക്ക് മാറ്റപ്പെടുന്ന അവസ്ഥയാണിത്. "പോളാർ", "നോൺ പോളാർ" എന്നീ പദങ്ങൾ സാധാരണയായി കോവാലന്റ് ബോണ്ടുകളിൽ പ്രയോഗിക്കുന്നു, ഒരു കോവാലന്റ് ബോണ്ടിന്റെ ധ്രുവത ഗണിച്ചെടുക്കാൻ, ആറ്റങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റി തമ്മിലുള്ള വ്യത്യാസം ഉപയോഗിക്കുന്നു.
ബോണ്ട് ധ്രുവീകരണം സാധാരണയായി മൂന്ന് ഗ്രൂപ്പുകളായി തിരിച്ചിരിക്കുന്നു, അവ രണ്ട് ബന്ധിത ആറ്റങ്ങൾ തമ്മിലുള്ള ഇലക്ട്രോനെഗറ്റിവിറ്റിയുടെ വ്യത്യാസത്തെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. പോളിങ് സ്കെയിൽ അനുസരിച്ച്:
- രണ്ട് ആറ്റങ്ങളും തമ്മിലുള്ള ഇലക്ട്രോനെഗറ്റിവിറ്റിയുടെ വ്യത്യാസം 0.5 ൽ കുറവാണെങ്കിൽ നോൺ പോളാർ ബോണ്ടുകൾ സാധാരണയായി സംഭവിക്കുന്നു
- രണ്ട് ആറ്റങ്ങളും തമ്മിലുള്ള ഇലക്ട്രോനെഗറ്റിവിറ്റിയുടെ വ്യത്യാസം ഏകദേശം 0.5 നും 2.0 നും ഇടയിലാണെന്നു വരികിൽ പോളാർ ബോണ്ടുകൾ രൂപപ്പെടുന്നു
- രണ്ട് ആറ്റങ്ങളും തമ്മിലുള്ള ഇലക്ട്രോനെഗറ്റിവിറ്റിയുടെ വ്യത്യാസം 2.0 -ൽ കൂടുതലാകുമ്പോൾ അയോണിക് ബോണ്ടുകൾ ഉണ്ടാകുന്നു.
തന്മാത്രാ ഘടനയും ധ്രുവതയും[തിരുത്തുക]
ഒരേ തരത്തിലുള്ള രണ്ട് ആറ്റങ്ങളുള്ള , ,, എന്നിങ്ങനെയുള്ള തന്മാത്രകളിൽ ധ്രുവീകരണം സാധ്യമല്ല. എന്നാൽ കാർബണ മോണോക്സൈഡ് , ഹൈഡ്രജൻ ഫ്ലൂറൈഡ് എന്നീ തന്മാത്രങ്ങളിൽ പങ്കാളി ആറ്റങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റിയിൽ വ്യത്യാസമുണ്ട് അതുകൊണ്ടുതന്നെ ഈ തന്മാത്രകൾക്ക് ഡൈപോൾ മോമെൻറ് ഉണ്ട്.

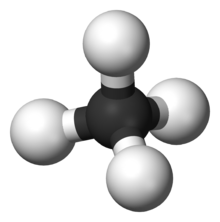
ഒന്നിലധികം ബോണ്ടുകളുള്ള തന്മാത്രകളുടെ ഡൈപോൾ മോമെൻറ് ഗണിച്ചെടുക്കാൻ അവയുടെ ത്രിമാന ഘടന കൂടി കണക്കിലെടുക്കേണ്ടതുണ്ട്. കാർബണും ഓക്സിജനും തമ്മിൽ ഇലക്ട്രോനെഗറ്റിവിറ്റിയിൽ വളരെ വ്യത്യാസമുണ്ട് എങ്കിലും കാർബൺ ഡൈഓക്സൈഡ് തന്മാത്രക്കയുടെ ഡൈപോൾ മൊമെൻറ് പൂജ്യമാണ്. കാരണം ഈ തന്മാത്രയുടെ ഘടന നേർരേഖയിലാണ്. വിപരീത ദിശകളിലുള്ള തുല്യമായ ഡൈപോളുകൾ പരസ്പരം റദ്ദാക്കപ്പെടുന്നു. മീഥൈൻ തന്മാത്രയിൽ കാർബൺ ആറ്റത്തിനു ചുറ്റുമായി ചതുർഫലക ജാമിതിയിൽ ഹൈഡ്രജൻ ആറ്റങ്ങൾ സ്ഥിതി ചെയ്യുന്നതിനാൽ ഉളവാകുന്ന ടെട്രാഹെഡ്രൽ സമമിതി കാരണം തന്മാത്രയുടെ ഡൈപോൾ മോമെൻറ് പൂജ്യമായിത്തീരുന്നു.
ധ്രുവതയും ഭൗതികഗുണങ്ങളും[തിരുത്തുക]
അവലംബം[തിരുത്തുക]
- ↑ 1.0 1.1 Pauling, Linus (1960). "3. The Partial Ionic Character of Covalent Bonds and the Relative Electronegativity of Atoms". Nature of the Chemical Bond (3 ed.). Cornell University Press. pp. 65–104.
- ↑ Pauling, Linus (1960). "Chapter IX: Electric Polarizabilities and Electric Dipole Moments of Atoms, Ions, and Molecules". Nature of The Chemical Bond. New York: Cornell University Press. pp. 605–608.
- ↑ Atkins, Peter; dePaula, Julio (2010). Physical Chemistry (9 ed.). Oxford University Press. pp. 622-628. ISBN 978-1-429-21812-2.
- ↑ Morrison, Robert T; Boyd, Robert N (2002). Organic Chemistry (6 ed.). New Delhi: Prentice Hall of India Pvt. Ltd. p. 23. ISBN 81 -203-0765-8.
- ↑ Sanderson, Robert Thomas (1983). Polar Covalence. A ademic Press. ISBN 978-0126180800.








