സമതാപ പ്രക്രിയ
വ്യൂഹത്തിന്റെ താപനിലയ്ക്ക് മാറ്റം വരാതെ നടക്കുന്ന താപഗതിക പ്രക്രിയയാണ് സമതാപപ്രക്രിയ (Isothermal Process) : Δ T = 0. താപകൈമാറ്റത്തിലൂടെ വ്യൂഹത്തിന് താപനില സ്ഥിരമായി നിലനിർത്താൻ തക്കവണ്ണം സാവധാനം നല്കിയാണ് ഈ പ്രക്രിയ നടക്കുന്നത്. ചുറ്റുപാടുമായി താപകൈമാറ്റം നടക്കാത്ത താപബദ്ധപ്രക്രിയ ഇതിനു വിപരീതമായ ഒരു പ്രക്രിയയാണ്. ( Q. = 0).
ചുരുക്കത്തിൽ, സമതാപപ്രക്രിയയെ നമുക്ക് ഇപ്രകാരം പറയാൻ കഴിയും
- മാതൃകാവാതകങ്ങൾക്ക് മാത്രം, ആന്തരിക ഊർജ്ജം
താപബദ്ധ പ്രക്രിയകളിൽ എല്ലായ്പ്പോഴും:
ഉദാഹരണങ്ങൾ[തിരുത്തുക]
ഉയർന്ന ഘടനയുള്ള യന്ത്രങ്ങൾ, ജീവനുള്ള കോശങ്ങൾ എന്നിവ ഉൾപ്പെടെ താപനില നിയന്ത്രിച്ചുനിർത്തേണ്ടതായ എല്ലാ വ്യൂഹങ്ങളിലും സമതാപപ്രക്രിയകൾ സംഭവിക്കുന്നു. ചില താപഎഞ്ചിനുകളുടെ പ്രവർത്തനപരിചക്രങ്ങളുടെ ചില ഭാഗങ്ങൾ സമതാപീയമായാണ് നടക്കുന്നത്. (ഉദാഹരണത്തിന്, കാർനോട്ട് പരിചക്രം ). [1] രാസപ്രവർത്തനങ്ങളുടെ താപഗതിക വിശകലനങ്ങളിൽ, സമതാപസാഹചര്യങ്ങളിൽ എന്താണ് സംഭവിക്കുന്നതെന്ന് ആദ്യം വിശകലനം ചെയ്യുകയും പിന്നീട് അതിൽ താപനിലയുടെ പ്രഭാവം പരിശോധിക്കുകയും ചെയ്യാറുണ്ട്. [2] , ഉരുകൽ അല്ലെങ്കിൽ ബാഷ്പീകരണംഎന്നിവ പോലുളള അവസ്ഥാന്തരങ്ങൾ സമതാപപ്രക്രിയകളാണ്, അവ സ്ഥിരമർദ്ദത്തിലാണ് സംഭവിക്കുന്നത്. [3] അതിസങ്കീർണമായ അസമതാപപ്രക്രിയകളെ വിശകലനം ചെയ്യുന്നതിന് സമതാപ പ്രക്രിയകൾ പലപ്പോഴും ഉപയോഗിക്കാറുണ്ട്.
ആദർശ വാതകത്തിനുള്ള വിശദാംശങ്ങൾ[തിരുത്തുക]

ബോയലിന്റെനിയമം ബാധകമാകുന്ന ഒരു വാതകത്തിന്റെ കാര്യത്തിൽ, വാതകം സമതാപ അവസ്ഥയിലാണെങ്കിൽ മർദ്ദംxവ്യാപ്തം (pV) ഒരു സ്ഥിരാങ്കമായിരിക്കും. ആ സ്ഥിരാങ്കത്തിന്റെ മൂല്യം nRT ആണ്, ഇവിടെ n എന്നത് വാതകത്തിന്റെ മോളുകളുടെ എണ്ണവും R ആദർശ വാതക സ്ഥിരാങ്കവുമാണ് . മറ്റൊരു വിധത്തിൽ പറഞ്ഞാൽ, ആദർശ വാതക നിയമം pV= nRT ബാധകമാണ്. അതുകൊണ്ട്:
ആകുന്നു. ഈ സമവാക്യം സൃഷ്ടിക്കുന്ന വക്രരേഖകളുടെ ഗണം ചിത്രം 1 ലെ ഗ്രാഫിൽ കാണിച്ചിരിക്കുന്നു. ഓരോ വക്രത്തെയും സമതാപരേഖ (Isotherm) എന്ന് വിളിക്കുന്നു. അത്തരം ഗ്രാഫുകളെ ഇൻഡിക്കേറ്റർ ഡയഗ്രം എന്ന് വിളിക്കുന്നു, എഞ്ചിനുകളുടെ കാര്യക്ഷമത നിരീക്ഷിക്കുന്നതിന് ജെയിംസ് വാട്ടും കൂട്ടരും ആണ് ഇത് ആദ്യമായി ഉപയോഗിച്ചത്. ചിത്രത്തിലെ ഓരോ വക്രരേഖയ്ക്കും സംഗതമായ താപനില താഴെ ഇടത് നിന്ന് മുകളിൽ വലത്തേക്ക് വർദ്ധിക്കുന്നു. ലോഗ് (p¹v1)
പ്രവൃത്തിയുടെ കണക്കുകൂട്ടൽ[തിരുത്തുക]
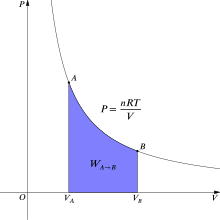
താപഗതികത്തിൽ, വാതകം എ-അവസ്ഥയിൽ നിന്ന് ബി-അവസ്ഥയിലേക്ക് മാറുമ്പോൾ പ്രതിലോമീയ പ്രവൃത്തി: [4]
ആദർശവാതകങ്ങളെ സംബന്ധിച്ചടത്തോളം ഒരു സമതാപീയ, പ്രതിലോമീയ പ്രക്രിയയിൽ, ഈ ഇൻ്റഗ്രൽ അതിന്റെ മർദ്ദവ്യാപ്തഗ്രാഫിലെ സമതാപരേഖയക്ക് കീഴിലുളള വിസ്തീർണത്തിന് തൂല്യമാണ്, ഇത് ചിത്രം 2 ൽ പർപ്പിൾ നിറത്തിൽ സൂചിപ്പിച്ചിരിക്കുന്നു. ആദർശവാതകസമവാക്യത്തിൽ T സ്ഥിരാങ്കമായതിനാൽ പ്രവൃത്തിയെ ഇപ്രകാരം എഴുതാം:
പ്രവൃത്തി എന്നാൽ സാധാരണയായി ഒരു വ്യൂഹത്തിനുമേൽ അതിന്റെ ചുറ്റുപാടുകളിൽ നിന്നും അനുഭവപ്പെടുന്ന പ്രവൃത്തി എന്നാണ് വിവക്ഷിക്കപ്പെടുന്നത്. ഉദാഹരണത്തിന്, വ്യൂഹം സമ്മർദ്ദനം ചെയ്യപ്പെട്ടാൽ, ആ പ്രവൃത്തി പോസിറ്റീവ് ആണ്, കൂടാതെ സിസ്റ്റത്തിന്റെ ആന്തരിക ഊർജ്ജം വർദ്ധിക്കുകയും ചെയ്യുന്നു. നേരെമറിച്ച്, വ്യൂഹം വികസിക്കുകയാണെങ്കിൽ, അത് ചുറ്റുപാടുകളിലേയ്ക്ക് ചെയ്ത പ്രവൃത്തിയാണ്. വ്യൂഹത്തിന്റെ ആന്തരിക ഊർജ്ജം കുറയുകയും ചെയ്യുന്നു.
ആദർശ വാതകങ്ങൾക്ക്, താപനില സ്ഥിരമായി നിലകൊള്ളുന്നുവെങ്കിൽ, വ്യൂഹത്തിന്റെ ആന്തരിക ഊർജ്ജവും സ്ഥിരമായിരിക്കും, അതായത് Δ U = 0. ഒന്നാം താപഗതിക നിയമപ്രകാരം U. = Q + W ( IUPAC കീഴ്വഴക്കം), ആയതിനാൽ ആദർശവാതകങ്ങളുടെ സമതാപീയ സമ്മർദ്ദനത്തിനും വികാസത്തിനും Q =-W എന്ന രീതി പിന്തുടരുന്നു.
ഒരു സമതാപപ്രക്രിയയുടെ ഉദാഹരണം[തിരുത്തുക]

മാതൃകാവാതകത്തിന്റെ പ്രതിലോമീയ വികാസം മൂലമുണ്ടാകുന്ന പ്രവൃത്തി സമതാപപ്രക്രിയമുഖാന്തിരം ഉണ്ടാകുന്ന പ്രവൃത്തിക്ക് ഉദാഹരണമാണ്.
ഉത്ക്രമത്തിലെ മാറ്റങ്ങൾ[തിരുത്തുക]
ഉത്ക്രമത്തിലെ (എൻട്രോപ്പി) മാറ്റങ്ങൾ കണക്കാക്കാൻ ഐസോതെർമൽ പ്രക്രിയകൾ പ്രത്യേകിച്ചും സൗകര്യപ്രദമാണ്, ഈ സാഹചര്യത്തിൽ, എൻട്രോപ്പി മാറ്റത്തിനുള്ള സൂത്രവാക്യം Δ S ,
ഇവിടെ Q rev എന്നത് സിസ്റ്റത്തിലേക്ക് പ്രതിലോമീയമായി കൈമാറ്റം ചെയ്യപ്പെടുന്ന താപവും T എന്നത് കേവല താപനിലയുമാണ് . [5] ഈ സൂത്രവാക്യം ഒരു സാങ്കൽപ്പിക റിവേർസിബിൾ പ്രക്രിയയ്ക്ക് മാത്രമേ ബാധകമാകൂ; അതായത്, എല്ലായ്പ്പോഴും സന്തുലിതാവസ്ഥ നിലനിർത്തുന്ന ഒരു പ്രക്രിയക്ക് മാത്രം.
സ്ഥിരമായ താപനിലയിലും മർദ്ദത്തിലും നടക്കുന്ന സന്തുലിതമായ ഒരു അവസ്ഥാന്തരം (ഉരുകൽ അല്ലെങ്കിൽ ബാഷ്പീകരണം പോലുള്ളവ) ഇതിന് ലളിതമായ ഒരു ഉദാഹരണംആണ്. സ്ഥിരമർദ്ദത്തിലുളള അവസ്ഥാന്തരം സംഭവിക്കുമ്പോൾ, വ്യൂഹത്തിലേക്ക് കൈമാറ്റം ചെയ്യപ്പെടുന്ന താപം പരിവർത്തനത്തിന്റെ എന്താൽപിക്ക് തുല്യമാണ്, Δ H tr, അപ്രകാരം, Q = Δ H tr . [3] ഏതൊരു മർദ്ദത്തിലും, രണ്ട് അവസ്ഥകൾ സന്തുലനമാകത്തക്കവിധം ഒരു പരിവർത്തന താപനില, T tr ഉണ്ടായിരിക്കും. (ഉദാഹരണത്തിന്, ഒരു അന്തരീക്ഷമർദ്ദത്തിൽ ഒരു ദ്രാവകത്തെ ബാഷ്പീകരിക്കുന്നതിനുള്ള സാധാരണ തിളനില). അത്തരം സന്തുലിതാവസ്ഥയിലാണ് പരിവർത്തനം നടക്കുന്നതെങ്കിൽ, ഉത്ക്രമത്തിലെ മാറ്റം നേരിട്ട് കണക്കാക്കാൻ മുകളിലുള്ള സമവാക്യം ഉപയോഗിക്കാം [5]
- .
പദോൽപ്പത്തി[തിരുത്തുക]
"ഐസോതെർമൽ" എന്ന വിശേഷണം ഗ്രീക്ക് പദങ്ങളായ "ἴσος" ("ഐസോസ്") "തുല്യം" എന്നും "താപം" എന്നർത്ഥം വരുന്ന "ημη" ("തെർം") എന്നിവയിൽ നിന്നാണ് ഉരുത്തിരിഞ്ഞത്.
ഇതും കാണുക[തിരുത്തുക]
- ജൂൾ-തോംസൺ പ്രഭാവം
- ജൂൾ വികാസം (സ്വതന്ത്ര വികാസം എന്നും വിളിക്കുന്നു)
- താപബദ്ധ പ്രക്രിയ
- ചാക്രിക പ്രക്രിയ
- സമമർദ്ദ പ്രക്രിയ
- സമവ്യാപ്ത പ്രക്രിയ
- പോളിട്രോപിക പ്രക്രിയ
- സ്വത പ്രക്രിയ
അവലംബം[തിരുത്തുക]
- ↑ Keenan, J. H. (1970). "Chapter 12: Heat-engine cycles". Thermodynamics. Cambridge, Massachusetts: MIT Press.
- ↑ Rock, P. A. (1983). "Chapter 11: Thermodynamics of chemical reactions". Chemical Thermodynamics. Mill Valley, CA: University Science Books. ISBN 0-935702-12-1.
- ↑ 3.0 3.1 Petrucci, R. H.; Harwood, W. S.; Herring, F. G.; Madura, J. D. (2007). "Chapter 12". General Chemistry. Upper Saddle River, NJ: Pearson. ISBN 978-0-13-149330-8. ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്; "Petrucci" എന്ന പേര് വ്യത്യസ്തമായ ഉള്ളടക്കത്തോടെ നിരവധി തവണ നിർവ്വചിച്ചിരിക്കുന്നു - ↑ Atkins, Peter (1997). "Chapter 2: The first law: the concepts". Physical Chemistry (6th ed.). New York, NY: W. H. Freeman and Co. ISBN 0-7167-2871-0.
- ↑ 5.0 5.1 Atkins, Peter (1997). "Chapter 4: The second law: the concepts". Physical Chemistry (6th ed.). New York, NY: W. H. Freeman and Co. ISBN 0-7167-2871-0. ഉദ്ധരിച്ചതിൽ പിഴവ്: അസാധുവായ
<ref>ടാഗ്; "Atkins4" എന്ന പേര് വ്യത്യസ്തമായ ഉള്ളടക്കത്തോടെ നിരവധി തവണ നിർവ്വചിച്ചിരിക്കുന്നു











