ഡൈബൊറേൻ

| |

| |
| Names | |
|---|---|
| IUPAC name
Diborane(6)
| |
| Other names
Boroethane
Boron hydride Diboron hexahydride | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.039.021 |
| EC Number |
|
| RTECS number |
|
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | Colorless gas |
| Odor | repulsive and sweet |
| സാന്ദ്രത | 1.216 g/L |
| ദ്രവണാങ്കം | |
| ക്വഥനാങ്കം | |
| Reacts[1] | |
| ബാഷ്പമർദ്ദം | 39.5 atm (16.6°C)[1] |
| Structure | |
| Tetrahedral (for boron) | |
| see text | |
| 0 D | |
| Hazards | |
| Main hazards | highly flammable, reacts with water |
| Explosive limits | 0.8%-88%[1] |
| Lethal dose or concentration (LD, LC): | |
LC50 (median concentration)
|
40 ppm (rat, 4 hr) 29 ppm (mouse, 4 hr) 40-80 ppm (rat, 4 hr) 159-181 ppm (rat, 15 min)[2] |
LCLo (lowest published)
|
125 ppm (dog, 2 hr) 50 ppm (hamster, 8 hr)[2] |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
TWA 0.1 ppm (0.1 mg/m3)[1] |
REL (Recommended)
|
TWA 0.1 ppm (0.1 mg/m3)[1] |
IDLH (Immediate danger)
|
15 ppm[1] |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
ഡൈബൊറേൻ ബോറോണും ഹൈഡ്രജനും ചേർന്ന രാസസംയുക്തമാണ്. ഇതിന്റെ രാസസൂത്രം B2H6 എന്നതാണ്. ഇത് നിറമില്ലാത്തതും മുറിയിലെ താപനിലയിൽ സ്ഥിരതയില്ലാത്തതുമായതും നല്ല മണമുള്ളതുമായ ഒരു വാതകമാകുന്നു. ഇതു വായുവുമായി നന്നായി ചേരുന്നു. പൊട്ടിത്തെറിക്കുന്ന സംയുക്തമാകുന്നു. സാധാരണ താപനിലയിൽ ഇത് ഈർപ്പമുള്ള വായുവുമായിച്ചേർന്ന് പെട്ടെന്ന് തീപിടിക്കുന്നു. ഇതിന്റെ മറ്റു പേരുകളാണ് : ബോറോഈതേൻ, ബോറോൺ ഹൈഡ്രൈഡ്, ഡൈബോറോൺ ഹെക്സാഹൈഡ്രൈഡ് എന്നിവ.
ഡൈബൊറേൻ വളരെയധികം ഉപയോഗക്ഷമമായ വാതകമാണ്.
ഡൈബൊറേൻ - ഘടനയും ബോണ്ടിങ്ങും[തിരുത്തുക]
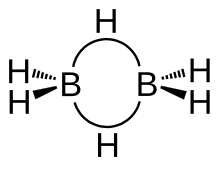
ഡൈബൊറേൻ D2h ഘടന കാണിക്കുന്നു.
ഉല്പാദനവും രൂപീകരണവും[തിരുത്തുക]
പലതരം ഉല്പാദനരീതികളുണ്ട്. വാണിജ്യപരമായി ഇതു നിർമ്മിക്കുന്നത്, BF3 സോഡിയം ഹൈഡ്രൈഡോ ലിഥിയം ഹൈഡ്രൈഡോ ലിഥിയം അലൂമിനിയം ഹൈഡ്രൈഡോ കൊണ്ട് നിരോക്സീകരണം നടത്തിയാണ്.[4]
- 8 BF3 + 6 LiH → B2H6 + 6 LiBF4
ഉപയോഗങ്ങൾ[തിരുത്തുക]
ഇതൊരു റോക്കറ്റു ഇന്ധനമായി ഉപയോഗിക്കാൻ ശ്രമിച്ചിരുന്നു. അർദ്ധചാലകങ്ങളുടെ ഉല്പാദനത്തിൽ ഇത് ഉപയോഗിച്ചുവരുന്നു.
അവലംബം[തിരുത്തുക]
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 "NIOSH Pocket Guide to Chemical Hazards #0183". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 2.0 2.1 "Diborane". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ "International Chemical Safety Cards - Diborane". CDC/NIOSH ICSC Database. NIOSH Education and Information Division. Retrieved 14 August 2015.
- ↑ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. Newyork: Academic Press. p. 773. ISBN 978-0121266011.
കൂടുതൽ വായനയ്ക്ക്[തിരുത്തുക]
H. C. Brown, H. C. (1975). Organic Synthesis via Boranes. New York: John Wiley. ISBN 0-471-11280-1.







