അണു
| Helium atom | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| ഹീലിയം ആറ്റത്തിന്റെ ഘടന വ്യക്തമാക്കുന്ന ചിത്രം. നടുവിൽ ന്യൂക്ലിയസും (പിങ്ക് നിറം) അതിനു ചുറ്റും ഇലക്ട്രോൺ മേഘപടലവും കാണാം. | ||||||||
| Classification | ||||||||
| ||||||||
| Properties | ||||||||
|
അണു (ആംഗലേയം: atom) അഥവാ ആറ്റം, ഒരു രാസമൂലകത്തിന്റെ എല്ലാ ഗുണങ്ങളും പ്രകടിപ്പിക്കുന്ന ഏറ്റവും ചെറിയ കണികയാണ്. പ്രപഞ്ചത്തിൽ ഉള്ള എല്ലാ പദാർത്ഥങ്ങളും നിർമ്മിക്കപ്പെട്ടിരിക്കുന്നത് വിവിധതരം അണുക്കളാലാണ്. (ഒരു രാസമൂലകത്തിൻ്റെ എല്ലാ ഗുണങ്ങളും പ്രകടിപ്പിക്കുന്ന ഏറ്റവും ചെറിയ കണികയെ തന്മാത്ര (മോളിക്യൂൾ) എന്നാണ് പറയുന്നത്.) ആറ്റം എന്ന പദം ഗ്രീക്ക് ഭാഷയിൽ നിന്നുമുള്ളതാണ്. ‘വിഭജിക്കാൻ സാധിക്കാത്തത്’ എന്നാണ് ആറ്റം എന്ന വാക്കിനർത്ഥം. അണു അവിഭാജ്യമായ കണികയൊന്നുമല്ല. ഒരു അണുവിൽ കാണപ്പെടുന്ന വിവിധ കണങ്ങളെ സബ് ആറ്റോമിക് കണങ്ങൾ എന്നു പറയുന്നു.[1][2]
അണുവിൽ പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ഒന്നു ചേർന്നിരിക്കുന്നു. സാന്ദ്രതയും പിണ്ഡവും ഏറിയ ഈ ഭാഗത്തെ അണുകേന്ദ്രം അഥവാ ന്യൂക്ലിയസ് എന്നു വിളിക്കുന്നു. പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ന്യൂക്ലിയസിന്റെ ഭാഗമാകയാൽ, ഈ കണങ്ങളെ പൊതുവേ ന്യൂക്ലിയോണുകൾ എന്നു വിളിക്കുന്നു. ഇലക്ട്രോണുകളുടെ പിണ്ഡം ന്യൂക്ലിയോണുകളെ അപേക്ഷിച്ച് തുലോം കുറവായതിനാൽ അണുവിന്റെ പിണ്ഡം മുഴുവനായി അണുകേന്ദ്രത്തിൽ തന്നെ കേന്ദ്രീകരിച്ചിരിക്കുകയാണെന്നു പറയാം. അണുകേന്ദ്രത്തിനു ചുറ്റുമുള്ള വളരെ വലിയ മേഖലയിൽ കേന്ദ്രത്തെ ചുറ്റുന്ന ഇലക്ട്രോണുകളെ , ആധുനിക സങ്കൽപ്പത്തിൽ ഇലക്ട്രോൺ മേഘം ആയി കണക്കാക്കുന്നു. അണുകേന്ദ്രത്തെ പിളർന്നാണ് ആണവോർജ്ജം ഉല്പ്പാദിപ്പിക്കുന്നത്.
ചരിത്രം[തിരുത്തുക]
ആറ്റത്തിനെ കുറിച്ചുളള ആദ്യത്തെ ആശയം ഇൻഡ്യയിൽ നിന്നായിരുന്നു. ബി.സി.ഇ. 600 നും 200നും ഇടയിൽ ജീവിച്ചിരുന്ന കണാദ മഹർഷി എല്ലാ വസ്തുക്കളും ചെറുകണങ്ങളാൽ നിർമ്മിതമാണെന്നു കണ്ടെത്തി.[3] ഏറ്റവും ചെറിയ കണത്തെ അദ്ദേഹം അണു എന്നു നാമകരണം ചെയ്തു.[3] രണ്ടണുക്കൾ ചേർന്നാൽ ദ്വയാണു ഉണ്ടാകും എന്ന് അദ്ദേഹം പ്രസ്താവിച്ചു. അനേകം അണുക്കൾ ചേർന്നാണു എല്ലാ ഭാരമുള്ള വസ്തുക്കളും ഉണ്ടാകുക എന്നും പറഞ്ഞു.[അവലംബം ആവശ്യമാണ്]
എല്ലാ വസ്തുക്കളും വിഭജിക്കാനാവാത്ത വിവിധതരത്തിലുള്ള ചെറു കണികകൾ കൊണ്ടു നിർമ്മിതമാണ് എന്ന് ബി.സി.ഇ. 460 മുതൽ 370 വരെ ജീവിച്ചിരുന്ന ഗ്രീക്ക് തത്ത്വചിന്തകനായ ഡെമോക്രിറ്റസ് അഭിപ്രായപ്പെട്ടിരുന്നു. ഇത്തരം കണികകളെ അദ്ദേഹം ആറ്റം എന്നു വിളിച്ചു. 1803-ൽ ഇംഗ്ലീഷ് രസതന്ത്രജ്ഞനായ ജോൺ ഡാൾട്ടൻ (1766-1844) ഒരു അണുസിദ്ധാന്തം മുന്നോട്ടു വച്ചു. ഓരോ മൂലകവും അതിന്റേതായ തരത്തിലുള്ള അണുക്കളാൽ നിർമ്മിതമാണെന്നായിരുന്നു അത്. വ്യത്യസ്ത തരത്തിലുള്ള അണുക്കൾ കൂടിച്ചേർന്ന് സംയുക്തങ്ങൾ ഉണ്ടാകുന്നുവെന്നു അദ്ദേഹം അഭിപ്രായപ്പെട്ടു.[1] 1827-ൽ ജീവശാസ്ത്രജ്ഞാനായിരുന്ന റോബർട്ട് ബ്രൗൺ ബ്രൗണിയൻ ചലനത്തിന് വിശദീകരണം നൽകിയപ്പോൾ ജലതന്മാത്രകളെക്കുറിച്ച് പരാമർശിച്ചു..[4][5][6]

1897-ൽ ഇംഗ്ലീഷ് ഭൌതികശാസ്ത്രജ്ഞനായ ജെ.ജെ. തോംസൺ ഇലക്ട്രോൺ കണ്ടെത്തി.അദ്ദേഹം മുന്നോട്ടുവച്ച ആറ്റം മാതൃക പ്ലം പുഡിങ് മാതൃക എന്നറിയപ്പെടുന്നു. ഏകദേശം 10−10 മീറ്റർ വ്യാസാർദ്ധമുള്ള ഗോളാകൃതിയിലുള്ള ആറ്റത്തിൽ, ഒരു പുഡ്ഡിംഗിൽ പ്ലം പഴങ്ങൾ എന്നപോലെ, വിരുദ്ധ ചാർജ്ജുള്ള കണങ്ങൾ ചിതറിക്കിടക്കുന്നു എന്ന് അദ്ദേഹം അഭിപ്രായപ്പെട്ടു. ആറ്റത്തിന്റെ വൈദ്യുത തുലനാവസ്ഥ വിശദീകരിയ്ക്കുവാൻ ഈ മാതൃകയ്ക്കു കഴിഞ്ഞുവെങ്കിലും ഹൈഡ്രജൻ സ്പെക്ട്രത്തെക്കുറിച്ച് വിശദീകരിയ്ക്കുന്നതിൽ പരാജയപ്പെട്ടു.[7][8]
1911-ൽ ഏണസ്റ്റ് റൂഥർഫോർഡ് സ്വർണത്തകിടിൽ തട്ടി ചിതറി പുറത്തുവരുന്ന ആൽഫാകണങ്ങളുടെ സ്വഭാവം പഠനവിധേയമാക്കി. അദ്ദേഹം ഒരേ സ്രോതസ്സിൽ നിന്നുള്ള ഒരുകൂട്ടം ആൽഫാ കണങ്ങളെ, കനം കുറഞ്ഞ ഒരു സ്വർണത്തകിടിൽ പതിക്കാനനുവദിച്ചു. ഭൂരിഭാഗം കണങ്ങളും ചലനഗതിയ്ക്ക് വ്യതിയാനം സംഭവിക്കാതെ പുറത്തേയ്ക്കു വന്നു. അതിൽനിന്നും ആറ്റത്തിനുള്ളിലെ 90% സ്ഥലവും ശൂന്യമാണെന്ന് റൂഥർഫോർഡ് അനുമാനിച്ചു. വളരെക്കുറച്ച് ആൽഫാകണങ്ങൾ ആറ്റത്താൽ ആഗിരണം ചെയ്യപ്പെട്ടു. അവ ആറ്റത്തിനുള്ളിൽ ചിതറിക്കിടക്കുന്ന നെഗറ്റീവ് ചാർജുള്ള കണങ്ങളുടെ സാന്നിദ്ധ്യത്തിന് തെളിവു നൽകി. എണ്ണായിരത്തിൽ ഒരു ആൽഫാകിരണത്തിന് സഞ്ചാരപഥത്തിൽ ഗണ്യമായ വ്യതിയാനം സംഭവിച്ചു. അതിൽ നിന്ന് ആറ്റത്തിനു നടുവിൽ വളരെച്ചെറിയ ഭാഗത്ത് പോസിറ്റീവ് ചാർജ്ജ് കേന്ദ്രീകരിയ്ക്കപ്പെട്ടിരിക്കുന്നതായി അനുമാനിക്കപ്പെട്ടു..[9]
പ്രസ്തുത പരീക്ഷണത്തിന്റെ അടിസ്ഥാനത്തിൽ റൂഥർഫോർഡ് ഒരു ആറ്റം മാതൃകയ്ക്ക് രൂപം നൽകി. സൗരയൂഥത്തിനു ചുറ്റും ഗ്രഹങ്ങൾ ചലിയ്ക്കുന്നതുപോലെ അണുകേന്ദ്രത്തിനു ചുറ്റും ഇലക്ട്രോണുകൾ സദാ ചലിച്ചുകൊണ്ടിരിക്കുന്നുവെന്നായിരുന്നു അദ്ദേഹത്തിന്റെ അനുമാനം. ആറ്റത്തിന്റെ കേന്ദ്രഭാഗത്ത് സ്ഥിതിചെയ്യുന്ന ന്യൂക്ലിയസിൽ ആറ്റത്തിന്റെ മുഴുവൻ പോസിറ്റീവ് ചാർജ്ജും ഭൂരിഭാഗം പിണ്ഡവും കേന്ദ്രീകരിയ്ക്കപ്പെട്ടിരിക്കുന്നുവെന്നും, അതിനുചുറ്റും ഇലക്ട്രോണുകൾ സദാ കറങ്ങിക്കൊണ്ടിരിക്കുന്നുവെന്നും അദ്ദേഹം അഭിപ്രായപ്പെട്ടു.സൗരയൂഥ മാതൃകയെന്നും ഈ ആറ്റം മോഡലിന് പേരുണ്ട്.[10]
ആറ്റത്തിന്റെ സ്ഥിരത വിശദീകരിയ്ക്കാൻ കഴിയാത്തതാണ് ഈ മാതൃകയുടെ പ്രധാന ന്യൂനത. നിരന്തരം ഭ്രമണം ചെയ്യുന്ന ഏതൊരു വസ്തുവിനെയും പോലെ ഇലക്ട്രോണും അഭികേന്ദ്രബലം മൂലമുണ്ടാകുന്ന ഊർജ്ജനഷ്ടത്തിന് വിധേയമാകും. അങ്ങനെ പൂർണമായും ഊർജ്ജം നഷ്ടപ്പെടുന്ന ഇലക്ട്രോണുകൾ ന്യൂക്ലിയസിൽ പതിച്ചാൽ ആറ്റം നശിക്കും. എന്നാൽ ആറ്റം സ്ഥിരമാണെന്ന് അതിനോടകം തന്നെ തെളിയിക്കപ്പെട്ടിരുന്നു. ഇക്കാരണത്താൽ റൂഥർഫോർഡിന്റെ ആറ്റം മാതൃക നിരസിയ്ക്കപ്പെട്ടു.[10]
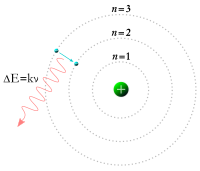
റൂഥർഫോർഡിന്റെ ആറ്റം മാതൃകയും, മാക്സ് പ്ലാങ്കിന്റെ ക്വാണ്ടം സിദ്ധാന്തത്തിലെ ചില ആശയങ്ങളും സംയോജിപ്പിച്ച് നീൽസ് ബോർ 1913-ൽ ബോർ മാതൃകയ്ക്ക് രൂപം നൽകി. ഇലക്ട്രോണുകളുടെ ഭ്രമണപഥത്തിന് അദ്ദേഹം ഓർബിറ്റ് അഥവാ ഷെൽ എന്ന പേരു നൽകി. ഓരോ ഭ്രമണപഥവും നിശ്ചിത ഊർജ്ജവും കോണീയസംവേഗവും(angular mementum) ഉള്ളവയാണെന്നും അവയുടെ സംവേഗം h/2╥ (h-പ്ലാങ്ക് സ്ഥിരാങ്കം)ന്റെ പൂർണസംഖ്യാഗുണിതങ്ങളായിരിക്കുമെന്നുംഅദ്ദേഹം അഭിപ്രായപ്പെട്ടു. താഴ്ന്ന ഊർജ്ജനിലയിലുള്ള ഒരു ഇലക്ട്രോണിന് ഊർജ്ജം സ്വീകരിച്ചുകൊണ്ട് ഉയർന്ന ഊർജ്ജനിലയിലേയ്ക്കും,ഉയർന്ന ഊർജ്ജനിലയിലുള്ളവയ്ക്ക് ഊർജ്ജം നഷ്ടപ്പെടുത്തിക്കൊണ്ട് താഴ്ന്ന ഊർജ്ജനിലയിലേയ്ക്കും പ്രയാണം നടത്താമെന്നും,അങ്ങനെ ആഗിരണം ചെയ്യപ്പെടുകയോ സ്വതന്ത്രമാക്കപ്പെടുകയോ ചെയ്യുന്ന ഊർജ്ജം e=hf(f-തരംഗത്തിന്റെ ആവൃത്തി) എന്ന സമവാക്യം അനുസരിക്കുന്നുവെന്നും അദ്ദേഹം പറഞ്ഞു.ഇങ്ങനെ ഇലക്ട്രോൺ സ്ഥാനാന്തരം മൂലമുണ്ടാകുന്ന ഊർജ്ജവ്യതിയാനം ഹൈഡ്രജൻ സ്പെൿട്രത്തിന്റെ രൂപവത്കരണത്തിന് കാരണമാകുന്നു എന്നതായിരുന്നു അദ്ദേഹത്തിന്റെ വിശദീകരണം.[11] [12]
1926-ൽ എർവിൻ ഷ്രോഡിങർ ഷ്രോഡിങർ സമവാക്യം വികസിപ്പിച്ചതോടെ ആറ്റത്തിന്റെ ഘടനയെക്കുറിച്ച് കൂടുതൽ വ്യക്തമായി.ആറ്റത്തിനുള്ളിൽ ഇലക്ട്രോണുകൾ കണ്ടെത്താൻ സാദ്ധ്യതയുള്ള സ്ഥലങ്ങളെ ഓർബിറ്റലുകൾ എന്നു വിളിച്ചു. ഓരോ പ്രധാന ഊർജ്ജനിലയ്ക്കും നിരവധി ഉപഊർജ്ജനിലകളും(സബ്ഷെല്ലുകൾ) ഓർബിറ്റലുകളും ഉണ്ടാകാമെന്ന് ക്വാണ്ടം സംഖ്യകളുടെ അടിസ്ഥാനത്തിൽ തെളിയിക്കപ്പെട്ടു.[13][14]ഹെയ്സൻബർഗ്ഗിന്റെ അനിശ്ചിതത്വതത്വവും,പോളിയുടെ സിദ്ധാന്തവും(Pauli's exclusion principle) ഓഫ്ബാ സിദ്ധാന്തവും(aufbau principle) ഓർബിറ്റലുകളിൽ ഇലക്ട്രോണുകൾ ക്രമീകരിക്കപ്പെട്ടിരിക്കുന്ന രീതി വിശദമാക്കി.
1950കളിൽ കണികാത്വരണികൾ ഉപയോഗിച്ചുള്ള പഠനത്തിൽ ന്യൂട്രോണും പ്രോട്ടോണും ഹാഡ്രണുകൾ കൊണ്ടും ഓരോ ഹാഡ്രണും ക്വാർക്കുകൾ കൊണ്ടും നിർമ്മിതമാണെന്ന് കണ്ടുപിടിച്ചു.[15][16] ഈ കണ്ടു പിടിത്തത്തിന് 1969-ൽ മുറെ ജെൽമാൻ എന്ന അമേരിക്കൻ ഭൗതികശാസ്ത്രജ്ഞന് നോബൽ സമ്മാനം ലഭിച്ചു. 1985-ൽ അമേരിക്കൻ ഭൗതികശാസ്ത്രജ്ഞനായ സ്റ്റീവ് ചു വും സംഘവും ലേസർ രശ്മികൾ ഉപയോഗിച്ച് ആറ്റത്തിനുള്ളിലെ താപനിലയ്ക്ക് വ്യതിയാനം വരുത്താമെന്ന് കണ്ടെത്തി.അതേ വർഷം തന്നെ വില്യം ഡി ഫിലിപ് സോഡിയം മാഗ്നെറ്റിക് ട്രാപ്പ് പ്രതിഭാസത്തിനും വിശദീകരണം നൽകി. ഈ രണ്ടു കണ്ടുപിടിത്തങ്ങളും ശീതീകരിച്ച ആറ്റങ്ങളിലെ ബോസ്-ഐൻസ്റ്റീൻ കണ്ടെൻസേഷൻ എന്ന അവസ്ഥയ്ക്ക് തെളിവു നൽകി. ഈ അവസ്ഥയിലുള്ള അണുക്കളുടെ സ്വഭാവം ഇന്നും പൂർണമായി നിർവചിയ്ക്കപ്പെട്ടിട്ടില്ല.[17]
ക്വാർക്കുകൾ ആറുതരത്തിലുണ്ടെന്നും, അവയിൽ അപ്,ഡൗൺ, ആന്റി-ക്വാർക്കുകളുടെ സമ്യോജനഫലമാണ് പ്രോട്ടോണും ന്യൂട്രോണുമടക്കമുള്ള അടിസ്ഥാനകണങ്ങളെന്നും ഇരുപതാം നൂറ്റാണ്ടിന്റെ അവസാനം തന്നെ കണ്ടെത്തിയിരുന്നു. ക്വാർക്ക് ഘടനയുടെ അടിസ്ഥാനത്തിൽ കണങ്ങൾ ബേരിയോണുകൾ, മീസോണുകൾ എന്നിങ്ങനെ തരംതിരിക്കപ്പെട്ടു. 2002-ൽ ജപ്പാനിൽ നടന്ന അന്താരാഷ്ട്ര ശാസ്ത്ര സമ്മേളനത്തിൽ പെന്റാക്വാർക്കുകൾ അഥവാ എക്സോട്ടിക് ബേരിയോൺ അവസ്ഥയുടെ സാന്നിദ്ധ്യം ചർച്ചചെയ്യപ്പെട്ടു. ബിഗ് ബാംഗ് സ്ഫോടനത്തിനു ശേഷം നിലനിന്നിരുന്ന ക്വാർക്ക് ഗ്ലുവോൺ പ്ലാസ്മയെന്ന ദ്രവ്യത്തിന്റെ അവസ്ഥ ലാർജ് ഹാഡ്രോൺ കൊളൈഡറിലൂടെ കൃത്രിമമായി പുനഃസൃഷ്ടിച്ച് അണുവിലെ മൗലികകണങ്ങളെക്കുറിച്ച് പഠിക്കാനുള്ള ശ്രമത്തിലാണ് ശാസ്ത്രജ്ഞർ ഇപ്പോൾ.
ഘടകങ്ങൾ[തിരുത്തുക]
അണുകേന്ദ്രം[തിരുത്തുക]

പോസിറ്റീവ് ചാർജ്ജുള്ള പ്രോട്ടോണുകളും, ചാർജ്ജ് രഹിത ന്യൂട്രോണുകളും അടങ്ങിയതും, അണുവിന്റെ പിണ്ഡം കേന്ദ്രീകരിയ്ക്കപ്പെട്ടിരിക്കുന്നതുമായ ഭാഗമാണ് അണുകേന്ദ്രം അഥവാ ന്യൂക്ലിയസ്. ന്യൂക്ലിയസിലെ ഘടകങ്ങൾ(ന്യൂട്രോണും പ്രോട്ടോണും)ന്യൂക്ലിയോണുകൾ എന്നറിയപ്പെടുന്നു. ഒരു അറ്റോമിക ന്യൂക്ലിയസിന്റെ ആകെ ചാർജ് ആറ്റത്തിന്റെ അണുസംഖ്യയ്ക്ക് തുല്യമായിരിക്കും.
പിണ്ഡസംഖ്യ Aആയ ഒരു ആറ്റത്തിന്റെ അണുകേന്ദ്രത്തിന്റെ വ്യാസാർദ്ധം ഫെറോമീറ്റർ ആയിരിക്കും.
ന്യൂക്ലിയസിന്റെ ഭാരം അതിലടങ്ങിയിരിക്കുന്ന പ്രോട്ടോണുകളുടെയും ന്യൂട്രോണുകളുടെയും ആകെ ഭാരത്തെക്കാൾ അല്പം കുറവായിരിക്കും. ന്യൂക്ലിയൊണുകളിൽ നിന്ന് ന്യൂക്ലിയസ് രൂപം കൊള്ളുമ്പോൾ, കുറച്ചു പിണ്ഡം ഊർജ്ജരൂപത്തിൽ നഷ്ടപ്പെടുന്നതാണിതിനു കാരണം. പിണ്ഡത്തിലുള്ള ഈ കുറവ് മാസ് ഡിഫക്ട് എന്നും അതിനു തത്തുല്യമായ ഊർജ്ജം(E=mc² എന്ന സമവാക്യപ്രകാരം) ബന്ധനോർജ്ജം(Binding Energy) എന്നും അറിയപ്പെടുന്നു. ഇത് ഒരു ന്യൂക്ലിയസിൽ നിന്ന് ഒരു പ്രോട്ടോണിനേയോ ന്യൂട്രോണിനെയോ നീക്കം ചെയ്യാനാവശ്യമായ ഊർജ്ജത്തിനു തുല്യമാണ്.
ഒരു അണുകേന്ദ്രത്തിന്റെ സ്ഥിരത അതിലടങ്ങിയിരിക്കുന്ന ന്യൂട്രോണുകളുടെയും പ്രോട്ടോണുകളുടെയും എണ്ണത്തെ ആശ്രയിച്ചിരിക്കുന്നു. ന്യൂട്രോൺ പ്രോട്ടോൺ അനുപാതം 1 ആയ അണുകേന്ദ്രങ്ങൾ സ്ഥിരമായിരിക്കും. പിണ്ഡസംഖ്യ 20ഓ അതിനു താഴെയോ ആയ മൂലക ആറ്റങ്ങളുടെ അണുകേന്ദ്രങ്ങളിൽ മാത്രമേ ഈ അനുപാതം കാണപ്പെടുന്നുള്ളൂ.ഈ അനുപാതം ഒന്നിൽ കുറവോ കൂടുതലോ ആയാ അണുകേന്ദ്രങ്ങൾ അസ്ഥിരമായിരികും.അവ റേഡിയോ ആക്ടിവിറ്റി പ്രകടിപ്പിക്കാനുള്ള സാദ്ധ്യത വളരെക്കൂടുതലാണ്. പിണ്ഡസംഖ്യ വർദ്ധിയ്ക്കുന്തോറും ന്യൂട്രോൺ പ്രോട്ടോൺ അനുപാതം 1.5 വരെ കൂടുന്നു.
ഉപാണുകണങ്ങൾ[തിരുത്തുക]
താഴെ പറയുന്ന കണങ്ങൾ ഒരു ആറ്റത്തിൽ കാണപ്പെടുന്നു;
- ഇലക്ട്രോൺ: ഋണ (negative) ചാർജ് വഹിക്കുന്ന കണങ്ങളാണിവ. പിണ്ഡത്തിലും വലിപ്പത്തിലും ആണുവിലെ മൂന്നു കണങ്ങളിൽ വച്ച് ഏറ്റവും ചെറുത്.ഒരു ഇലക്ട്രോൺ കണത്തിൻറ്റെ പിണ്ഡം 9.11x10−31kg ആയി കണക്കാക്കുന്നു.
- പ്രോട്ടോൺ: ധന (positive) ചാർജ് വഹിക്കുന്ന ഉപ ആറ്റോമിക കണം. പിണ്ഡം ഇലക്ട്രോണിന്റെ പിണ്ഡത്തിന്റെ 1836 മടങ്ങാണ്.
- ന്യൂട്രോൺ: ചാർജില്ലാത്ത കണമാണ് ഇത്. ഇലക്ട്രോണിന്റെ 1839 മടങ്ങാണ് ഇതിന്റെ പിണ്ഡം.
ക്വാർക്കുകൾ എന്ന അടിസ്ഥാന കണങ്ങൾ കൊണ്ടാണ് പ്രോട്ടോൺ,ന്യൂട്രോൺ എന്നിവ നിർമ്മിതമായിരിക്കുന്നത്.ആറ്റോമിക കണങ്ങളുടെ എണ്ണം ഓരോ മൂലകങ്ങളുടെ അണുക്കളിലും വ്യത്യസ്തമാണ്. ഒരേ മൂലകത്തിന്റെ അണുക്കളിൽ പ്രോട്ടോണുകളുടെ എണ്ണം തുല്യമായിരിക്കും.പ്രോട്ടോണുകളുടേയും ഇലക്ട്രോണുകളുടേയും എണ്ണം തുല്യമാണെങ്കിൽ അണു വൈദ്യുതപരമായി തുലനാവസ്ഥയിലായിരിക്കും(neutral). ഇലക്ട്രോണുകളുടെ എണ്ണം പ്രോട്ടോണുകളുടെ എണ്ണത്തേക്കാൾ കൂടുതലോ കുറവോ ആണെങ്കിൽ അവയെ അയോൺ എന്നു വിളിക്കുന്നു.
| സവിശേഷത | ഇലക്ട്രോൺ | പ്രോട്ടോൺ | ന്യൂട്രോൺ |
|---|---|---|---|
| ചാർജ്ജ് | നെഗറ്റീവ് | പോസിറ്റീവ് | ചാർജ്ജില്ല |
| പിണ്ഡം | ഹൈഡ്രജൻ ആറ്റത്തിന്റെ ഭാരം x 1/1837 | ഹൈഡ്രജൻ ആറ്റത്തിന്റേതിനു തുല്യം | ഹൈഡ്രജൻ ആറ്റത്തിന്റേതിനു തുല്യം |
| ദ്രവ്യമാനം(Rest mass) | 9.1x 10−31 | 1.672x10−27 | 1.675x−27 |
| ഭ്രമണം | ഉണ്ട് | ഉണ്ട് | ഉണ്ട് |
| സ്ഥിരത | സ്ഥിരം | സ്ഥിരം | ന്യൂക്ലിയസിനു പുറത്ത് അസ്ഥിരം |
| ചാർജ്ജിന്റെ അളവ് | 1.602x10−19 | 1.602x10−19 | 0 |
ന്യൂക്ലിയർ ഫിഷൻ, ഫ്യൂഷൻ, റേഡിയോ ആക്റ്റിവിറ്റി ക്ഷയം എന്നീ പ്രവർത്തനങ്ങൾ മൂലം അണുവിലെ പ്രോട്ടോണുകളുടേയും ന്യൂട്രോണുകളുടേയും എണ്ണത്തിലും മാറ്റം വരുന്നു. അങ്ങനെ ഒരു മൂലകത്തിന്റെ അണു മറ്റൊരു മൂലകമായി രൂപാന്തരം പ്രാപിക്കുന്നു.
ഇലക്ട്രോൺ മേഘം[തിരുത്തുക]

ഇലക്ട്രോണുകൾ അണുകേന്ദ്രത്തെ വലംവയ്ക്കുന്നത് നിശ്ചിതപാതകളിലൂടെയാണ്. ഈ സഞ്ചാരപാത, ഇലക്ട്രോൺ പഥങ്ങൾ അഥവാ ഓർബിറ്റുകൾ എന്നറിയപ്പെടുന്നു. ഓരോ ഓർബിറ്റും നിശ്ചിത ഊർജ്ജം ഉള്ളവയാണ്. ഈ ഓർബിറ്റുകൾ സബ്ഷെല്ലുകളായും, ഓർബിറ്റലുകളായും വിഭജിയ്ക്കപ്പെട്ടിരിക്കുന്നു. എന്നാൽ അനിശ്ചിതത്വതത്വപ്രകാരം ഒരു നിശ്ചിത സമയത്ത് ഇലക്ട്രോണിന്റെ സ്ഥാനമോ പ്രവേഗമോ കൃത്യമായി നിർവചിയ്ക്കാൻ സാദ്ധ്യമല്ല. അതുകൊണ്ടു തന്നെ ഇലക്ട്രോൺ കാണപ്പെടാൻ സാദ്ധ്യതയുള്ള പ്രദേശങ്ങൾ നെഗറ്റീവ് ചാർജ്ജുള്ള് ഇലക്ട്രോൺ മേഘങ്ങളായി കണക്കാക്കുന്നു. ഇത്തരത്തിൽ ഒരു ആറ്റത്തിൽ ഇലക്ട്രോണുകൾ കാണാൻ സാദ്ധ്യതയുള്ള മേഖലയാണ് ഓർബിറ്റൽ എന്നറിയപ്പെടുന്നത്. ഈ സാദ്ധ്യത (Electron probability) ഷ്രോഡിങർ സമവാക്യത്തിന്റെ നിർദ്ധാരണമൂല്യത്തിന്റെ വർഗ്ഗത്തിനു തുല്യമാണ്.
അണുകേന്ദ്രത്തിൽ നിന്നുള്ള അകലം വർദ്ധിയ്ക്കുന്തോറും ഓർബിറ്റുകളുടെ ഊർജ്ജവും വർദ്ധിയ്ക്കുന്നു.അതോടൊപ്പം ഇലക്ട്രോണുകളെ ഉൾക്കൊള്ളാനുള്ള അവയുടെ ശേഷിയും വർദ്ധിയ്ക്കുന്നു. അതായത്, ഓരോ ഓർബിറ്റിലും ഇലക്ട്രോണുകളെ കണ്ടു മുട്ടാനുള്ള സാദ്ധ്യത കൂടുന്നു. ഊർജ്ജവ്യതിയാനമനുസരിച്ച് ഓർബിറ്റലുകളുടെ അകൃതിയ്ക്കും വലിപ്പത്തിനും വ്യത്യാസമുണ്ടാകുന്നു. s,p,d,f എന്നിങ്ങനെ നാല് ഓർബിറ്റലുകളാണ് ആറ്റത്തിലുള്ളത്. ഈ ഓർബിറ്റലുകളിൽ ഊർജ്ജവ്യതിയാനമനുസരിച്ച് ഇലക്ട്രോണുകൾ വിന്യസിയ്ക്കപ്പെട്ടിരിക്കുന്നു.
അണുവിന്റെ ഘടന[തിരുത്തുക]
ആദ്യകാലത്ത് ആറ്റത്തിന്റെ ഘടനയെ സൗരയൂഥത്തോട് ഉപമിച്ചിരുന്നു . സൂര്യനും, സൂര്യനെ നിശ്ചിത അകലങ്ങളിൽ ഭ്രമണം ചെയ്യുന്ന ഗ്രഹങ്ങളും ചേർന്നതാണല്ലോ സൗരയൂഥം . ഓരോ ഗ്രഹത്തിനും അതിന്റേതായ ഭ്രമണപഥവുമുണ്ട്. സൂര്യനെ അണുവിനുള്ളിലെ ന്യൂക്ലിയസ്സായി സങ്കൽപ്പിച്ചാൽ ഇലക്ട്രോണുകളെ സൂര്യനു ചുറ്റും ഭ്രമണം ചെയ്യുന്ന ഗ്രഹങ്ങളായി കരുതാം . അണുവിൽ ന്യൂക്ലിയസ്സിനും , ഇലക്ട്രോണുകൾക്കുമിടയിൽ ധാരാളം സ്ഥലം ഉണ്ടെന്നും കരുതിപ്പോന്നു.എന്നാൽ ഡി ബ്രോളി തരംഗസിദ്ധാന്തപ്രകാരം പുതിയ ആറ്റം മാതൃകയ്ക്ക് രൂപം കൊടുക്കുകയും ക്വാണ്ടം സംഖ്യകളുടെ അടിസ്ഥാനത്തിൽ ഓർബിറ്റലുകളുടെ ആകൃതി നിർവചിയ്ക്കപ്പെടുകയും ചെയ്തതോടെ ആറ്റത്തിന്റെ ഘടന കൂടുതൽ സങ്കീർണമായി.വൈദ്യുതകാന്തികതരംഗവുമായുള്ള ആറ്റങ്ങളുടെ പ്രതിപ്രവർത്തനം ആധാരമാക്കിയാണ് ആറ്റത്തിന്റെ ഇലക്ട്രോണിക മാതൃക തയ്യാറാക്കിയത്.
പ്രധാന ഊർജ്ജനിലകൾ[തിരുത്തുക]
ഇലക്ട്രോണുകൾ അണുകേന്ദ്രത്തെ ചുറ്റി സഞ്ചരിക്കുന്നത് വ്യത്യസ്ത ഊർജ്ജനിലകളിലാണ് . ഇങ്ങനെയുള്ള സഞ്ചാരപഥത്തെ ഷെൽ അഥവാ ഓർബിറ്റ് എന്നു പറയുന്നു . K , L ,M , N , O , P , Q (അല്ലെങ്കിൽ 1 ,2 ,3 ,4 ,5 ,6 ,7) ഇങ്ങനെ പരമാവധി ഏഴ് ഷെല്ലുകളാണ് ഒരു ആറ്റത്തിൽ ഉണ്ടാവുക .
പ്രിൻസിപ്പൽ ക്വാണ്ടം സംഖ്യയാണ് ഓർബിറ്റുകളെ സൂചിപ്പിയ്ക്കാനായി ഉപയോഗിക്കാറ്. ന്യൂക്ലിയസിൽ നിന്നുള്ള അകലം വർദ്ധിയ്ക്കുന്തോറും പ്രിൻസിപ്പൽ ക്വാണ്ടം സംഖ്യയുടെ മൂല്യവും ഓർബിറ്റുകളുടെ ഊർജ്ജവും വർദ്ധിയ്ക്കുന്നു. പ്രിൻസിപ്പൽ ക്വാണ്ടം സംഖ്യ n ആയ ഒരു പ്രധാന ഊർജ്ജനിലയിൽ 2n² ഇലക്ട്രോണുകൾ ഉണ്ടാവാം. അതായത്,ആദ്യത്തെ ഷെൽ ആയ K യിൽ 2 ഇലക്ട്രോണുകളും പിന്നീട് യഥാക്രമം 8 , 8 , 18 , 18 , 32 , 32 എണ്ണം വീതം ഇലക്ട്രോണുകളാണ് L , M ,N ,O, P,Q എന്നീ ഷെല്ലുകളിൽ ഉണ്ടാവേണ്ടത് .അഷ്ടകനിയമപ്രകാരം അവസാനഷെല്ലിൽ എട്ട് ഇലക്ട്രോണുകൾ ഉള്ള മൂലക ആറ്റം സ്ഥിരത കൈവരിക്കുന്നു.
ഉപഊർജ്ജനിലകൾ[തിരുത്തുക]
അസിമുത്തൽ ക്വാണ്ടം സംഖ്യയാണ് ഉപഊർജ്ജനിലകളെ പ്രതിനിധീകരിക്കുന്നത്. ഒരു പ്രധാന ഊർജ്ജനിലയിലെ ഉപഊർജ്ജനിലകളുടെ എൺണം അതിന്റെ പ്രിൻസിപ്പൽ ക്വാണ്ടം സംഖ്യ(n)യ്ക്ക് തുല്യമായിരിക്കും. 0 മുതൽ n-1 വരെയുള്ള സംഖ്യകൾ s,p,d,f എന്നീ ഉപഊർജ്ജനിലകളെ പ്രതിനിധീകരിക്കാൻ ഉപയോഗിക്കുന്നു.
ഓർബിറ്റലുകൾ[തിരുത്തുക]
ഒരു അണുകേന്ദ്രത്തിനു ചുറ്റും ഇലക്ട്രോൺ കാണപ്പെടാൻ സാദ്ധ്യതയുള്ള മേഖലയാണ് ഓർബിറ്റൽ. ഇത് കാന്തിക ക്വാണ്ടം സംഖ്യ ഉപയോഗിച്ചാണ് സൂചിപ്പിയ്ക്കപ്പെടുന്നത്. അസിമുത്തൽ ക്വാണ്ടം സംഖ്യ l ആയ ഒരു ഉപഊർജ്ജനിലയിൽ -l മുതൽ +l വരെ ഓർബിറ്റലുകൾ ഉണ്ടാവാം. s,p,d,f എന്നീ അക്ഷരങ്ങളാണ് ഓർബിറ്റലുകളെ പ്രതിനിധീകരിക്കുന്നത്. ഓർബിറ്റലുകളുടെ അക്ഷങ്ങളിലെ അഥവാ അക്ഷങ്ങൾ ഉൾക്കൊള്ളുന്ന പ്രതലങ്ങളിലെ ദിക്വിന്യാസം അനുസരിച്ച് അവയുടെ ഊർജ്ജത്തിലും ആകൃതിയിലും വ്യത്യാസം സംഭവിയ്ക്കും. ഒരു ഓർബിറ്റലിൽ ഉൾക്കൊള്ളാവുന്ന പരമാവധി ഇലക്ട്രൊണുകളുടെ എണ്ണം 2 ആണ്. ഈ രണ്ട് ഇലക്ട്രോണുകളും വ്യത്യസ്ത ഭ്രമണദിശ ഉള്ളവയായിരിക്കും.
സവിശേഷതകൾ[തിരുത്തുക]
അറ്റോമികസംഖ്യയും പിണ്ഡസംഖ്യയും[തിരുത്തുക]
പ്രോട്ടോണുകളുടെ എണ്ണത്തെയാണ് ആറ്റോമിക സംഖ്യ (ആംഗലേയം: atomic number) എന്നു പറയുന്നത്. ഒരു മൂലകത്തിന്റെ ഭൗതികസ്വഭാവവും രാസസ്വഭാവവും നിശ്ചയിക്കപ്പെടുന്നത് അറ്റോമിക സംഖ്യയുടെ അടിസ്ഥാനത്തിലാണ്. ഇംഗ്ലീഷ് അക്ഷരമാലയിലെ Z എന്ന അക്ഷരമാണ് അറ്റോമികസംഖ്യയെ സൂചിപ്പിക്കാൻ സാധാരണയായി ഉപയോഗിക്കാറ്.
പ്രോട്ടോണുകളുടേയും ന്യൂട്രോണുകളുടേയും ആകെ എണ്ണമാണ് പിണ്ഡസംഖ്യ(ആംഗലേയം: mass number).ന്യൂക്ലിയസിന്റെ പിണ്ഡം സൂചിപ്പിയ്ക്കുന്ന സംഖ്യയാണിത്. A എന്ന അക്ഷരം കൊണ്ട് സൂചിപ്പിക്കുന്നു.
അറ്റോമികസംഖ്യയിൽ നിന്ന് പിണ്ഡസംഖ്യ കുറച്ചാൽ(A-Z) ആകെ ന്യൂട്രോണുകളുടെ എണ്ണം ലഭിയ്ക്കും.
ഐസോട്ടോപ്പുകൾ[തിരുത്തുക]
ഒരേ മൂലകത്തിന്റെ വ്യത്യസ്ത അണുക്കളിൽ ന്യൂട്രോണിന്റെ എണ്ണത്തിൽ ചിലപ്പോൾ മാറ്റമുണ്ടാകാറുണ്ട്. ഇത്തരം വ്യത്യസ്ത പിണ്ഡമുള്ള ഒരേ മൂലകത്തിന്റെ തന്നെ അണുക്കളെ ഐസോട്ടോപ്പുകൾ എന്നു വിളിക്കുന്നു. ഇലക്ട്രോണുകളുടെ എണ്ണം പൊതുവേ പ്രോട്ടോണുകളുടെ എണ്ണത്തിനു തുല്യമാണ്. എന്നാൽ ഇലക്ടോണുകളും അണുകേന്ദ്രവുമായുള്ള ബന്ധനത്തിന്റെ ശക്തി കുറവായാൽ, ഇലക്ട്രോണുകളുടെ എണ്ണത്തിന് എളുപ്പത്തിൽ മാറ്റം സംഭവിക്കാം.
പ്രോട്ടിയം(1H1),ഡ്യുട്ടീരിയം(1H2),ട്രീറ്റിയം(1H3) എന്നിവ ഹൈഡ്രജന്റെ മൂന്ന് പ്രകൃത്യാ ഉള്ള ഐസോട്ടോപ്പുകൾ ആണ്.
ഐസോബാറുകൾ[തിരുത്തുക]
ഒരേ പിണ്ഡസംഖ്യയുള്ള മൂലക ആറ്റങ്ങളാണ് ഐസോബാറുകൾ. ഇവയുടെ അറ്റോമികസംഖ്യകൾ വ്യത്യാസപ്പെട്ടിരിക്കും. 1840Ar, 1940K, 2040Ca എന്നിവ ഐസോബാറുകൾക്ക് ഉദാഹരണമാണ്.
ഐസോടോണുകൾ[തിരുത്തുക]
ന്യൂട്രോണുകളുടെ എണ്ണം തുല്യമായ വ്യത്യസ്ത മൂലക ആറ്റങ്ങളാണ് ഐസോടോണുകൾ(Isotones). 14Si30,15P31, 16S32 എന്നിവ ഉദാഹരണങ്ങളാണ്
അറ്റോമികഭാരം[തിരുത്തുക]
കാർബൺ -12നെ ആധാരമാക്കിയാണ് സാധാരണയായി അറ്റോമികഭാരം കണക്കാക്കാറ്. ഏകീകൃത അറ്റോമിക് മാസ് യൂണിറ്റ്( unified atomic mass unit-u) അഥവാ ഡാൾട്ടൺ(dalton-Da) ആണ് അറ്റോമികഭാരത്തിന്റെ ഏകകം. ഇത് ഒരു കാർബൺ -12 ആറ്റത്തിന്റെ ഭാരത്തിന്റെ 1/12നു തുല്യമാണ്.
1 u = 1/NA gram = 1/ (1000 NA) kg ( NA - അവോഗാഡ്രോ സംഖ്യ) 1 u = 1.660538782(83)×10−27 kg = 931.494027(23) MeV
ഹൈഡ്രജൻ ആറ്റത്തിന്റെ ഭാരം ഏകദേശം 1u ആണ്. അതായത്, യൂണിഫൈഡ് അറ്റോമിക് മാസ് യൂണിറ്റിൽ ഒരു അണുവിന്റെ ഭാരം അതിന്റെ പിണ്ഡസംഖ്യയ്ക്ക് തുല്യമാണ്. സ്ഥിരതയുള്ള(stable) ഏറ്റവും ഭാരംകൂടിയ ആറ്റം ലെഡ്-208 ആണ്. ഇതിന്റെ ഭാരം 207.9766521 uഉം.
സാധാരണയായി പരീക്ഷണശാലകളിൽ അറ്റോമികഭാരം മോൾ ആയാണ് കണക്കാക്കാറ്.
ആറ്റത്തിന്റെ വലിപ്പം[തിരുത്തുക]
അണുവിന്റെ ആരത്തെ(Atomic radius) അടിസ്ഥാനമാക്കിയാണ് അതിന്റെ വലിപ്പം കണക്കാക്കുന്നത്.അണുവിന്റെ ആരം ആപേക്ഷികമാണ്. ഏർപ്പെട്ടിരിക്കുന്ന രാസബന്ധനത്തിന്റെ സ്വഭാവം, സമീപത്തുള്ള ആറ്റങ്ങളുടെ എണ്ണം, ഭ്രമണം(spin) എന്നിവയെല്ലാം അറ്റോമിക ആരത്തെ സ്വാധീനിക്കുന്നു. ഇലക്ട്രോണുകൾ കാണപ്പെടാനുള്ള സാധ്യത അഥവാ ഇലക്ട്രോൺ മേഘപടലങ്ങളുടെ സ്ഥാനം ആറ്റത്തിന്റെ ചുറ്റുപാടുകളെ ആധാരമാക്കി മാറികൊണ്ടിരിക്കുന്നതാണ് അറ്റോമിക ആരത്തിന്റെ ആപേക്ഷിക സ്വഭാവത്തിനു കാരണം.
ആവർത്തനപ്പട്ടികയിൽ മുകളിൽ നിന്നു താഴോട്ടുപോകുന്തോറും ന്യൂക്ലിയസിനു ചുറ്റുമുള്ള ഷെല്ലുകളുടെ എണ്ണം വർദ്ധിക്കുന്നതിനാൽ ആറ്റത്തിന്റെ വലിപ്പവും വർദ്ധിക്കുന്നു. അതായത് ഒന്നാമത്തെ ഗ്രൂപ്പിൽ ഏറ്റവും താഴെയുള്ള ഫ്രാൻസിയവും സീസിയവുമാണ് ഏറ്റവും വലിയ ആറ്റങ്ങൾ. എന്നാൽ ആറ്റങ്ങൾക്ക് പിരീഡിൽ ഇടത്തുനിന്നു വലത്തോട്ടു പോകുന്തോറും അറ്റോമിക സംഖ്യയുടെ ആരോഹണക്രമമനുസരിച്ച് വലിപ്പം കുറയുന്നു. പിരീഡിൽ ഇടത്തുനിന്നു വലത്തോട്ടു പോകുന്തോറും ന്യൂക്ലിയസിലെ പ്രോട്ടോണുകളുടെ എണ്ണം വർദ്ധിക്കുന്നതും അതനുസരിച്ച് ഇലക്ട്രോൺ സമൂഹം കൂടുതൽ ശക്തിയോടെ ന്യൂക്ലിയസ്സിലേക്ക് ആകർഷിക്കപ്പെടുന്നതുമാണ് ഈ പ്രവണതയ്ക്കു കാരണം. ഹീലിയം ആണ് ഏറ്റവും ചെറിയ ആറ്റം. ഹീലിയം കഴിഞ്ഞാൽ ആവർത്തനപ്പട്ടികയിൽ മുകളിൽ വലത്തെ അറ്റത്തുള്ള നിയോണും ഫ്ലൂറിനും ആണ് യഥാക്രമം ഏറ്റവും ചെറിയ രണ്ടാമത്തേയും മൂന്നാമത്തേയും ആറ്റങ്ങൾ.
കാന്തിക ആഘൂർണം(Magnetic moment)[തിരുത്തുക]
ഇലക്ട്രോണുകൾ അണുകേന്ദ്രത്തെ വലം വയ്ക്കുന്നതോടൊപ്പം സ്വയം ഭ്രമണം ചെയ്യുകയും ചെയ്യുന്നു. സ്വയം ഭ്രമണം മൂലമുള്ള ഇലക്ട്രോണുകളുടെ ആന്തരകോണീയ സംവേഗം അഥവാ ചക്രണം(spin) ക്വാണ്ടം ബലതന്ത്രത്തിൽ് ഡിറാക് സ്ഥിരാങ്ക(ലഘൂകരിച്ച പ്ലാങ്ക് സ്ഥിരാങ്കം,ħ) ത്തിന്റെ ഭിന്നസംഘ്യാഗുണിതങ്ങളായാണ് സൂചിപ്പിക്കാറ്.ഉദാഹരണത്തിന് ½ ħ ഇലക്ട്രോണിന്റെ ചക്രണം സൂചിപ്പിക്കുന്നു.ഇതോടൊപ്പം അണുകേന്ദ്രത്തിനു ചുറ്റുമുള്ള പരിക്രമണം അവയുടെ കക്ഷക കോണീയ സംവേഗ(orbital angular momentum)ത്തിനും കാരണമാകുന്നു.ചക്രണവും കക്ഷക കോണീയ സംവേഗവും ചേർന്ന് angular momentum coupling വഴി ആറ്റത്തിന്റെ സദിശ കാന്തികമണ്ഡലം അഥവാ കാന്തിക ആഘൂർണം[18] നിർണയിക്കുന്നു. ആറ്റത്തിന്റെ Magnetic moment കണ്ടെത്താനുള്ള സമവാക്യം, ആണ്. ഇവിടെ J ആറ്റത്തിന്റെ ആകെ കോണീയ സംവേഗത്തെ സൂചിപ്പിക്കുന്ന ക്വാണ്ടം സംഖ്യയും(total angular momentum quantum number),gJ ലൻഡെ ജി-ഘടക(Lande g-factor) വും μB ബോർ മാഗ്നറ്റണും ആണ്
രാസബന്ധനം[തിരുത്തുക]
അണുകേന്ദ്രത്തിൽ നിന്നും ഏറ്റവും അകലെയുള്ള ഇലക്ട്രോണുകളെ മറ്റു അണുക്കൾക്ക് കൈമാറിയോ അവയുമായി പങ്കിടുകയോ ചെയ്തുകൊണ്ടാണ് അണുക്കൾ രാസബന്ധനത്തിൽ ഏർപ്പെടുന്നത്. ഇങ്ങനെയാണ് തന്മാത്രകളും മറ്റു രാസസംയുക്തങ്ങളും ഉണ്ടാകുന്നത്.
അണുക്കൾ രസതന്ത്രത്തിന്റെ അടിസ്ഥാന ഘടകങ്ങളാണ്. രാസപ്രവർത്തനങ്ങളിൽ ഇവ വിഘടിക്കപ്പെടുന്നില്ല. അതായത് ഒരു രാസപ്രവർത്തനത്തിനു ശേഷം ഉണ്ടാകുന്ന അണുക്കളുടെ എണ്ണം അതിൽ പങ്കെടുത്ത അണുക്കളുടേതിന് തുല്യമായിരിക്കും.
അവലംബം[തിരുത്തുക]
- ഡോർലിങ് കിൻഡർസ്ലെയ് - കൺസൈസ് എൻസൈക്ലോപീഡിയ സയൻസ് - ലേഖകൻ: നീൽ ആർഡ്ലി
- ↑ 1.0 1.1 Haubold, Hans (1998). "Microcosmos: From Leucippus to Yukawa". Structure of the Universe. Common Sense Science. Archived from the original on 2008-10-01. Retrieved 2008-01-17.
{{cite web}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Harrison (2003:123–139).
- ↑ 3.0 3.1 Bal Ram Singh (2003). "umassd.edu : Use of Chemistry to Understand Vedic Knowledge" (PDF). Use of Chemistry to Understand Vedic Knowledge (in ഇംഗ്ലീഷ്). Center for Indic Studies, and Department of Chemistry and Biochemistry, Univers ity of Massachusetts Dartmouth, Dartmouth, MA 02747. Archived from the original (PDF) on 2013-11-09. Retrieved 2013 ജൂൺ 24.
{{cite web}}: Check date values in:|accessdate=(help) - ↑ Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). Annalen der Physik (in German). 322 (8): 549–560. doi:10.1002/andp.19053220806. Archived from the original (PDF) on 2006-03-18. Retrieved 2007-02-04.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: unrecognized language (link) - ↑ Mazo (2002:1–7).
- ↑ Lee, Y. K. (1995). "Brownian Motion". Imperial College, London. Archived from the original on 2007-12-18. Retrieved 2007-12-18.
{{cite web}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Text Book for Physics, Class XII, Part II, NCERT
- ↑ The Nobel Foundation (1906). "J.J. Thomson". Nobelprize.org. Retrieved 2007-12-20.
- ↑ Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom". Philosophical Magazine. 21: 669–88. Archived from the original on 2008-01-14. Retrieved 2008-01-18.
- ↑ 10.0 10.1 Modern Physics, R. Murugeshan ,Published By S Chand &Co, ISBN 81-219-0210
- ↑ Stern, David P. (May 16, 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA Goddard Space Flight Center. Archived from the original on 2007-08-20. Retrieved 2007-12-20.
- ↑ Bohr, Niels (December 11, 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". The Nobel Foundation. Retrieved 2008-02-16.
- ↑ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. Retrieved 2007-12-21.
- ↑ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto. Retrieved 2007-12-21.
{{cite web}}: Unknown parameter|month=ignored (help) - ↑ Kullander, Sven (August 28, 2001). "Accelerators and Nobel Laureates". The Nobel Foundation. Retrieved 2008-01-31.
- ↑ Staff (October 17, 1990). "The Nobel Prize in Physics 1990". The Nobel Foundation. Retrieved 2008-01-31.
- ↑ Staff (October 15, 1997). "The Nobel Prize in Physics 1997". Nobel Foundation. Retrieved 2008-02-10.
- ↑
Dictionary of Science & Technology. SISO Books. 2000.
{{cite book}}:|first=missing|last=(help)

![{\displaystyle {\begin{smallmatrix}1.07\cdot {\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dbdc96c9208a88ea1f1692a6f6f6e4480843de24)
